
某温度下,在体积不变的容器中进行反应:CO(g)+2H2(g) CH3OH(g) △H1=-90.7 kJ•mol-1。已知反应的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L;5 min后反应达平衡,此时CO的转化率为50%。则下列说法正确的是:
A.该反应属于熵增放热反应,一定能自发进行
B.5 min内H2的平均反应速率为0.1 mol/(L·min)
C.其它条件不变的情况下,加入催化剂可提高CO的转化率
D.若该温度下,反应物的起始浓度c(CO)=4 mol/L,c(H2)=a mol/L,达到平衡后,
c(CH3OH)=2 mol/L,则a=5.4
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法正确的是
A.将1 L 2 mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA
B.1 L 0.1 mol/L NaHSO4溶液中含有0.1 NA个HSO4-
C.常温常压下,23 g NO2和N2O4的混合气体一定含有NA个氧原子
D.1 mol铁与足量稀盐酸反应转移的电子数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
化学知识在生产、生活中有着广泛的应用。下列说法中不正确的是:
A.用植物秸秆、动物粪便等生产的沼气是一种清洁的能源
B.手机上用的锂离子电池属于二次电池
C.海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化
D.研制开发燃料电池汽车,可有效降低机动车尾气污染
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的说法正确的是:
A.中和滴定时,用待测溶液润洗锥形瓶
B.使用pH试纸测定溶液pH时先润湿,则测得溶液的pH一定偏小
C.用酸式滴定管量取12.00 mL高锰酸钾溶液
D.在配制的硫酸亚铁溶液常加入一定量的铁粉和盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
镁是一种重要的金属资源,工业上制取镁单质主要是电解法。
(1)电解法制取镁单质的反应方程式是:______________________________。
(2)电解原料无水氯化镁可由海水制备。主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩冷却结晶。
其步骤先后顺序是__________________________________;(每步骤可重复使用)
(3)上述步骤①中“一定条件下”具体是指:_______________________________,其目的是___________________________________________。
(4)已知某温度下Mg(OH)2的Ksp=6.4×l0−12,当溶液中c(Mg2+)≤1.0×10−5mol·L−1可视为沉淀完全,则此温度下应保持溶液中c(OH-)≥_________________ mol·L−1。
(5)饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,看到的现象是___________。反应原理可能有两方面,请分别用离子方程式表示:
①________________________________________________;
②________________________________________________。
要验证①②谁是Mg(OH)2溶解的主要原因,可选取________代替NH4Cl溶液作对照实验。
A.NH4NO3 B.(NH4)2SO4 C.CH3COONH4 D.NH4HCO3
(6)镁电池是近年来科学技术研究的热点之一。一种“镁—次氯酸盐”电池的总反应为:
Mg + ClO- + H2O == Mg(OH)2 + Cl- 。其工作时正极的电极反应式:_________________;用此镁电池给铅蓄电池充电,下列说法中正确的是______________________________。
A.镁电池正极与铅蓄电池正极相连
B.电子从Pb电极转移到镁电池负极
C.充电后,铅蓄电池两极质量均减小,理论上镁电池消耗24 g Mg,阴、阳极的质量变化之比为3︰2
D.充电后,镁电池和铅蓄电池的pH均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置和方法进行相应实验,能达到实验目的的是
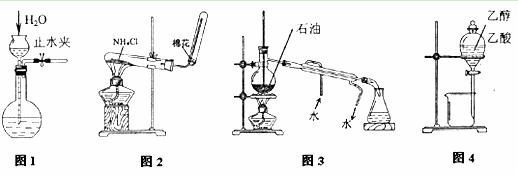
A.用图1所示方法检查装置的气密性 B.用图2所示装置和方法制取氨气
C.用图3所示装置和方法进行石油分馏 D.用图4装置和方法分离乙醇与乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)钠镁铝三种元素中第一电离能最大的是 (填元素名称)。
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为 。
(3)微粒间存在非极性键、配位键、氢键及范德华力的是 。
A. NH4Cl晶体 B. Na3AlF6晶体 C. Na2CO3•10H2O晶体
D. CuSO4溶液 E. CH3COOH溶液
(4)部分共价键键能数据如下表:
| 键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 159 | 418 | 945 |
根据上表数据推算并写出氨气分解为氮气和氢气的热化学方程式:
。
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
| 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 | |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4 °C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
乙醇和二甲醚沸点及水溶性差异的主要原因是 。
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液。该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体析出,请画出呈深蓝色的离子的结构简式 。
(7)石墨烯的应用为电子行业的发展带来了重大的突破,其结构可以看作是单层的石墨,其中碳原子的杂化方式为 ;C60的晶体结构类似于干冰,则每个C60晶胞的质量为 (用含NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某氯化镁溶液的密度为1.18 g·cm-3,其中镁离子的质量分数为5.1%,300 mL该溶液中Cl-的物质的量约等于( )
A.0.37 mol B.0.63 mol
C.0.74 mol D.1.5 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com