
| A、SO2溶于水可以导电,说明SO2是电解质 |
| B、电解质本身可以导电,也可以不导电 |
| C、强电解质与弱电解质的差别就是溶液导电性不同 |
| D、物质的量浓度相同的NaOH溶液与氨水,氨水的pH值较小,说明氨水是弱电解质 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、等温等物质的量浓度溶液中,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大 |
| B、0.2 mol/L NH4Cl溶液和0.1 mol/LNaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C、物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| D、同浓度的下列溶液中:①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4 ④NH3?H2O,c(NH4+)由大到小的顺序是①>②>③>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
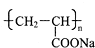 )具有超强吸水性,能吸收空气中的水分,可用于矿山道路运输抑尘等.下列叙述不正确的是( )
)具有超强吸水性,能吸收空气中的水分,可用于矿山道路运输抑尘等.下列叙述不正确的是( )| A、聚丙烯酸钠属于混合物 |
| B、聚丙烯酸钠属于天然有机高分子化合物 |
| C、聚丙烯酸钠可用于生产“尿不湿” |
| D、路面喷洒聚丙烯酸钠溶液能抑制扬尘,一定程度上能预防雾霾和PM2.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
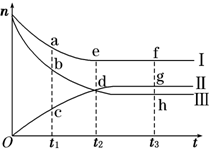 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示.
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应是复分解反应 |
| B、Na2SO3发生氧化反应 |
| C、H2SO4是氧化剂 |
| D、NaClO3是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子数变化如图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne原子的核外电子数相差1,Y的单质是一种常见的半导体材料,Z的非金属性在同周期元素中最强.下列说法正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子数变化如图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne原子的核外电子数相差1,Y的单质是一种常见的半导体材料,Z的非金属性在同周期元素中最强.下列说法正确的是( )| A、对应简单离子半径:X>W |
| B、对应气态氢化物的稳定性Y>Z |
| C、化合物XZW既含离子键,又含共价键 |
| D、Y的氧化物与Z的氧化物和X的最高价氧化物对应的水化物均能反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com