
 新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ•mol-1.
新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ•mol-1.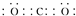 .
.分析 (1)二氧化碳为共价化合物,结构式为O=C=O;
(2)2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-a kJ•mol-1①
2NO(g)+O2(g)=2NO2(g)△H=-b kJ•mol-1②
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-c kJ•mol-1③
由盖斯定律可知①-②+2×③得 4CO(g)+2NO2(g)=N2(g)+4CO2(g);
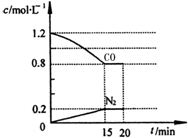
(3)①将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,由图可知生成氮气为0.2mol,则
2CO(g)+2NO(g)?N2(g)+2CO2(g)
起始浓度(mol•L-1) 1.2 1 0 0
转化浓度(mol•L-1) 0.4 0.4 0.2 0.4
平衡浓度(mol•L-1) 0.8 0.6 0.2 0.4
②改变反应条件,导致CO浓度减小,可使平衡正向移动,但不能加CO或缩小体积;
③结合Qc与K的关系判断反应的移动方向.
解答 解:(1)二氧化碳为共价化合物,结构式为O=C=O,则CO2的电子式为 ,
,
故答案为: ;
;
(2)2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-a kJ•mol-1①
2NO(g)+O2(g)=2NO2(g)△H=-b kJ•mol-1②
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-c kJ•mol-1③
由①-②+2×③得 4CO(g)+2NO2(g)=N2(g)+4CO2(g)△H=(-a+b-2c) kJ•mol-1,
故答案为:4CO(g)+2NO2(g)=N2(g)+4CO2(g)△H=(-a+b-2c) kJ•mol-1;
(3)①将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,则
2CO(g)+2NO(g)?N2(g)+2CO2(g)
起始浓度(mol•L-1) 1.2 1 0 0
转化浓度(mol•L-1) 0.4 0.4 0.2 0.4
平衡浓度(mol•L-1) 0.8 0.6 0.2 0.4
有害气体NO的转化率为$\frac{0.4}{1}$×100%=40%;0~15min NO的平均速率v(NO)=$\frac{0.4mol/L}{15min}$=0.027mol/(L•min),化学平衡常数K=$\frac{{0.2×{{0.4}^2}}}{{0.8×{{0.6}^2}}}$=0.14,
故答案为:40%;0.027mol/(L•min);
②a.缩小容器体积,CO浓度增大,故a错误;
b.增加CO的量,CO浓度增大,故b错误;
c.降低温度,正向移动,CO浓度减小,故c正确;
d.扩大容器体积,CO浓度减小,故d正确;
故答案为:c d;
③20min时再向容器中充入NO、N2各0.4mol,此时各成分的浓度变为
2CO(g)+2NO(g)?N2(g)+2CO2(g)
瞬时浓度(mol•L-1) 0.8 0.6 0.4 0.6
Qc=$\frac{{0.4×{{0.6}^2}}}{{0.8×{{0.6}^2}}}$=0.625>0.14,所以逆向移动;化学平衡常数只和温度有关,温度不变,平衡常数不变,所以化学平衡常数还是$\frac{5}{36}$L/mol或0.14 L/mol,
故答案为:逆向;$\frac{5}{36}$L/mol或0.14 L/mol.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、K的计算、盖斯定律应用为解答的关键,侧重分析与应用能力的考查,注意化学反应原理的综合应用,综合性较强,题目难度不大.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 能够发生化学反应的碰撞是有效碰撞 | |
| B. | 增大浓度会加快化学反应速率,其原因是增加了单位体积内活化分子的数目 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-53.7kJ•mol-1,若将含0.5 molH2SO4的稀硫酸与含0.5molBa(OH)2的溶液混合,放出的热量大于53.7kJ | |
| D. | 若化学平衡正向移动,则反应物的转化率会增大,平衡常数也必发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050、 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com