
| A. | 只有① | B. | ①③⑥ | C. | ②④⑤⑥⑦ | D. | ①③⑤⑥ |
分析 ①原子核外电子排布相同的离子,核电核数越大,半径越大,离子的原子核外电子层数越多,半径越大;
②元素的非金属性越强,对应的氢化物越稳定;
③元素的非金属性越强,对应阴离子的还原性越弱;
④元素的非金属性越强,对应单质的氧化性越强;
⑤元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
⑥含氢键的物质沸点最高,氢化物的相对分子质量越大沸点越大;
⑦同周期元素从左到右元素的非金属性逐渐增强,同主族元素从上到下元素的非金属性逐渐减弱;
⑧同周期元素从左到右元素的逐渐减弱,同主族元素从上到下元素的金属性逐渐增强.
解答 解:①K+、S2-、Cl-原子核外电子排布相同,核电核数S2-<Cl-<K+,则半径S2->Cl->K+,离子的原子核外电子层数越多,半径越大,核外电子层数最小,则半径最小,则有S2->Cl->K+>Al3+,故①错误;
②非金属性:F>Cl>S>P>Si,元素的非金属性越强,对应的氢化物越稳定,则氢化物的稳定性:HF>HCl>H2S>PH3>SiH4,故②正确;
③非金属性:Cl>Br>I>S,元素的非金属性越强,对应阴离子的还原性越弱,则还原性:Cl-<Br-<I-<S2-,故③错误;
④非金属性:Cl>S>Se>Te,元素的非金属性越强,对应单质的氧化性越强,则氧化性:Cl2>S>Se>Te,故④正确;
⑤非金属性:Cl>S>P>C,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性HClO4>H2SO4>H3PO4>H2CO3,所以酸性:H2SO4>H3PO4>H2CO3>HClO,故⑤正确;
⑥含氢键的物质沸点最高,氢化物的相对分子质量越大沸点越大,则沸点为H2O>H2Se>H2S;故⑥错误;
⑦因同周期元素从左到右元素的非金属性逐渐增强,则有O>N、P>Si,同主族元素从上到下元素的非金属性逐渐减弱,则N>P,所以有非金属性:O>N>P>Si,故⑦正确;
⑧同周期元素从左到右元素的逐渐减弱,则金属性Ca<K,同主族元素从上到下元素的金属性逐渐增强,则金属性Be<Mg<Ca,所以金属性:Be<Mg<Ca<K,故⑧正确;
故选B.
点评 本题考查元素周期表与周期律的递变性,为高频考点,把握元素周期律、元素性质的比较等为解答的关键,学习中注重基础知识的积累,题目难度中等.


科目:高中化学 来源: 题型:解答题
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解 9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(巳知硝酸只被还原为NO气体).
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解 9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(巳知硝酸只被还原为NO气体).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 双糖 | B. | 多糖 | C. | 氨基酸 | D. | 脂肪 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲基丙酸乙酯的分子式是C6H12O2 | |
| B. | 用乙醇与NaOH的醇溶液共热消去制乙烯 | |
| C. | 分子式是C5H12O的醇共有8种(不考虑立体异构) | |
| D. |  中可能有6个碳原子在同一直线上 中可能有6个碳原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
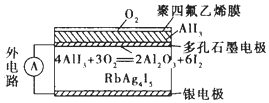 固体离子导体依靠离子迁移传导电流.如图是一种固体电池,Ag+在RbAg4I5晶体中迁移,空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,Ag和I2作用形成原电池.下列说法错误的是( )
固体离子导体依靠离子迁移传导电流.如图是一种固体电池,Ag+在RbAg4I5晶体中迁移,空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,Ag和I2作用形成原电池.下列说法错误的是( )| A. | I2与Ag反应属于放热反应 | |
| B. | Ag+从多孔石墨电极向银电极移动 | |
| C. | 多孔石墨电极为正极,银电极为负极 | |
| D. | 银电极的电极反应式为Ag-e-═Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基丙烷和正戊烷互为同系物 | |
| B. |  的一氯代物有4种 的一氯代物有4种 | |
| C. | 苯和聚乙烯均能发生加成反应 | |
| D. | 以淀粉为原料可制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氢氧化钠溶液迅速倒入盛有盐酸的量热计中 | |
| B. | 浓硫酸加水稀释 | |
| C. | 氯化铵固体和氢氧化钡固体在烧杯中混合搅拌 | |
| D. | 甲烷的燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com