
【题目】2019年10月9日,瑞典皇家科学院在斯德哥尔摩宣布,将2019年诺贝尔化学奖颁发给来自美国、英国、日本的三位科学家,表彰他们在锂离子电池方面的研究贡献。高度评价他们“创造了一个可充电的世界”。锂离子电池与传统电池相比,充电更快,功率密度更高,使用时间更长,在手机和笔记本电脑等便携式电子产品上广泛应用。工业上常以锂辉矿(主要成分为 LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂,其中一种工艺流程如下:

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:

②Li2CO3的溶解度随温度变化如图所示:
试回答下列问题:
(1)酸浸时,为了提高浸取率可采取升高温度、粉碎矿石、搅拌、过滤后再次浸取等措施还可通过_______来提高浸取率。
(2)反应I中应调节pH范围为_______,沉淀A的成分除H2SiO3、CaCO3、Al(OH)3外,还有___________。
(3)反应Ⅱ的离子方程式为_________________。
(4)“操作I"的名称为______;洗涤Li2CO3沉淀要使用_______ (选填“热水”或“冷水”),理由是___________________________________________________。
【答案】延长浸取时间(或:增大酸的浓度) 4.7~9.6(或4.7≤ pH < 9.6) Fe(OH)3、CaSO4 Mg2++Ca(OH)2=Ca2++Mg(OH)2↓ (或:Mg2++2OH-=Mg(OH)2↓) CO32-+Ca(OH)2=CaCO3↓+2OH-(或:Ca2++CO32-= CaCO3↓) 过滤 热水 碳酸锂的溶解度随温度升高而降低,热水洗涤可以减少碳酸锂的溶解损失
【解析】
锂辉矿(主要成分为 LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂,加入过量硫酸溶解锂辉矿,再加入碳酸钙调节溶液的pH,加入双氧水将溶液里的亚铁离子氧化为铁离子,使铁离子和铝离子沉淀完全,过滤除去沉淀,然后加入氢氧化钙和碳酸钠除去溶液中的钙离子和镁离子,过滤得到的溶液中主要是锂离子的水溶液,蒸发浓缩,加入饱和的碳酸钠溶液沉淀锂离子生成碳酸锂,洗涤后加入盐酸溶解得到氯化锂溶液,加热蒸干得到氯化锂,电解氯化锂得到金属锂。根据以上分析解答此题。
(1)增大酸的浓度、升高温度、增大固体表面积、搅拌或延长浸取时间可以提高浸取率,所以为了提高浸取率可采取升高温度、粉碎矿石、搅拌、过滤后再次浸取等措施还可通过延长浸取时间或增大酸的浓度来提高浸取率;
答案为:延长浸取时间(或:增大酸的浓度)。
(2)反应Ⅰ中调节pH的目的是除去Fe3+、Al3+,由表中数据可知调节pH范围为4.7~9.6(或4.7≤pH<9.6),硫酸钙微溶于水,所以沉淀A的成分除H2SiO3、CaCO3、Al(OH)3外,还有Fe(OH)3、CaSO4 ;
答案为:4.7~9.6(或4.7≤pH<9.6);Fe(OH)3、CaSO4。
(3)反应Ⅱ调节pH=11,目的是除去Mg2+和Ca2+,根据加入的试剂,主要离子方程式为:Mg2++Ca(OH)2= Ca2++ Mg(OH)2↓(或:Mg2++2OH-=Mg(OH)2↓)、CO32-+ Ca(OH)2=CaCO3↓+2OH-(或:CO32-+ Ca2+=CaCO3↓);
答案为:Mg2++Ca(OH)2= Ca2++ Mg(OH)2↓(或:Mg2++2OH-=Mg(OH)2↓)、CO32-+ Ca(OH)2=CaCO3↓+2OH-(或:CO32-+ Ca2+=CaCO3↓)。
(4)“操作Ⅰ”目的是分离出固体碳酸锂,所以“操作Ⅰ”是过滤;由图可知碳酸锂的溶解度随温度升高而降低,热水洗涤可以减少碳酸锂的溶解损失,所以洗涤碳酸锂沉淀要用热水;
答案为:过滤;热水 ;碳酸锂的溶解度随温度升高而降低,热水洗涤可以减少碳酸锂的溶解损失。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】有三种有机化合物的结构如图,下列说法错误的是
![]()
A. 三种物质的分子式均为C8H8,它们互为同分异构体
B. x的一氯代物有5种
C. y的四氯代物有3种
D. z中的所有原子在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高良姜素是姜科植物高良姜根中的提取物,它能使鼠伤寒沙门氏菌TA98和TA100发生诱变,具有抗病菌作用.下列关于高良姜素的叙述正确的是( )
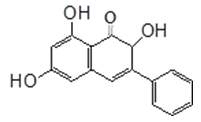
A.高良姜素的分子式为C15H15O5
B.高良姜素分子中含有3个羟基、8个双键
C.高良姜素能与碳酸钠溶液、溴水、酸性高锰酸钾溶液等反应
D.1mol高良姜素与足量的钠反应生成33.6LH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多硫化钠Na2Sx(x≥2)在结构上与Na2O2、FeS2等有相似之处,Na2Sx在碱性溶液中可被NaClO氧化成Na2SO4,而NaClO被还原成NaCl,反应中Na2Sx与NaClO的物质的量之比为1:16,则x值是( )
A.5B.4C.3D.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以色列理工学院的丹尼尔·谢德曼因“发现准晶体”而一人独享了2011年度诺贝尔化学奖。某组成为Al65Cu23Fe12的准晶体W具有低摩擦系数、高硬度、低表面能以及低传热性,正被开发为炒菜锅的镀层。下列有关说法中正确的是( )
A.W的熔点比铝、铁、铜的都高
B.将一定量W投入少量的盐酸中,充分反应后溶液中一定有Fe2+
C.等质量W分别与足量NaOH溶液、盐酸反应,生成氢气的质量之比为65:73
D.W在氯气中完全燃烧时可形成AlCl3、FeCl3两种离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下图进行喷泉实验,已知圆底烧瓶内充满X气体,胶头滴管内装有少量Y液体,烧杯内装有足量Z液体,下列组合能进行喷泉实验且最终液体一定能充满整个烧瓶的是( )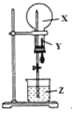
X气体 | Y试剂 | Z试剂 | |
A. | NO2 | H2O | H2O |
B. | CO2 | H2O | H2O |
C. | HCl | 饱和食盐水 | 水 |
D. | NO2 和O2 | H2O | H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列反应属于吸热反应的是_________________________
①铝粉与氧化铁粉末反应 ②酸碱中和反应 ③硝酸铵溶于水 ④碳酸钙分解 ⑤H2在Cl2中燃烧 ⑥灼热的碳与CO2的反应 ⑦NH4Cl晶体与Ba(OH)28H2O混合搅拌
(2)在25℃、101kPa的条件下,断裂1mol H—H键吸收436 kJ能量,断裂1 mol Cl—Cl键吸收243 kJ能量,形成1mol H—Cl键放出431 kJ能量。该条件下H2+Cl2=2HCl反应中的能量变化可用如图表示:
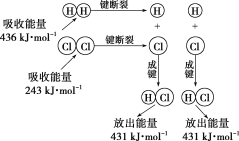
现有1 mol H2和1 mol Cl2在25℃、101 kPa下完全反应。请根据上述信息回答下列有关问题:
①该反应的热化学方程式为_____________
②反应物的总能量___________(填“>”或“<”)生成物的总能量。
(3)直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。如图所示:

1 mol CH4完全燃烧生成气态水的能量变化和1 mol S(g)燃烧的能量变化。在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式____________。
(4)几种含硅元素的物质之间的相互转化关系如图所示:
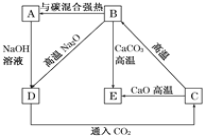
①写出下列反应的化学方程式:
B→A:_________;
B→E:_________。
②写出下列溶液中反应的离子方程式:D→C_________。
(5)Mg6Si4O10(OH)8用氧化物的形式可表示为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由一氧化氮与氯气在常温常压下合成。已知NOCl是一种红褐色液体或黄色气体,其熔点是-64.5℃,沸点是-5.5℃,遇水易水解。回答下列问题:
(1)实验室制备原料气NO和Cl2的装置如下图所示。

①实验室制NO时,装置A中烧瓶内发生反应的化学方程式为______________。
②实验室制Cl2时,装置B的作用是______________________。
(2)将上述收集到的Cl2充入集气瓶中,按图示装置制备亚硝酰氯。
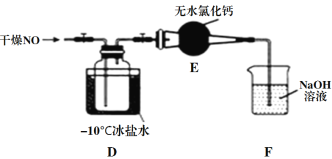
①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_____________。
②装置D中的现象为_____________________________________________。
③装置E中无水氯化钙的作用为_______________________________。
④某同学认为装置F不能吸收NO,为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M(如图所示)可用于制备各种高性能防腐蚀涂料。W、X、Y、Z是原子序数依次增大的短周期主族元素,且占据三个不同周期,W与Z的质子数之和是X的2倍。下列说法不正确的是
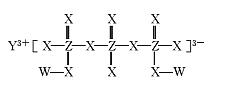
A.原子半径:Y>Z>X
B.X元素的族序数是Y元素的2倍
C.工业上电解熔融Y2X3化合物制备单质Y
D.W与X形成的所有化合物都只含极性共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com