
下表中物质的分类组合完全正确的是( )
| 编号 | A | B | C | D |
| 强电解质 | Ba(OH)2 | 盐酸 | HClO4 | BaSO4 |
| 弱电解质 | HI | CaCO3 | HClO | NH3·H2O |
| 非电解质 | SO2 | NH3 | Cl2 | 乙醇 |
科目:高中化学 来源: 题型:
为了除去MgCl2酸性溶性中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后再加入适量盐酸。这种试剂是
A.NH3·H2O B.NaOH C.Na2CO3 D.MgO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,不是氧化还原反应的是 ( )
①H2+Cl2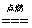 2HCl ②Na2CO3+2HCl==2NaCl+H2O+CO2↑ ③2H2O
2HCl ②Na2CO3+2HCl==2NaCl+H2O+CO2↑ ③2H2O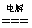 2H2↑+O2↑
2H2↑+O2↑
④CuO+2HNO3==Cu(NO3)2+H2O ⑤2HgO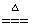 2Hg+O2↑
2Hg+O2↑
A. ②④ B. ①③ C. ①②③ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
单质X和Y相互反应生成X2+和Y2—,现有下列叙述:①X被氧化 ②X是氧化剂 ③X具有氧化性 ④Y2—是还原产物 ⑤Y2—具有还原性 ⑥X2+具有氧化性 ⑦Y的氧化性比X2+氧化性强,其中正确的是
A.①②③④ B.①④⑤⑥⑦ C.②③④ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.氧化还原反应的本质是元素化合价发生变化 B.还原剂是一种能够得到电子的物质
C.物质所含元素化合价升高的反应是还原反应 D.氧化反应和还原反应是同时发生的
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度、相同浓度下的六种盐溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分别为( )
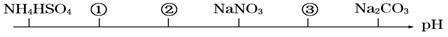
A.NH4Cl (NH4)2SO4 CH3COONa B.(NH4)2SO4 NH4Cl CH3COONa
C.(NH4)2SO4 NH4Cl NaOH D.CH3COOH NH4Cl (NH4)2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关滴定操作的顺序正确的是( )
①检查滴定管是否漏水 ②用蒸馏水洗涤玻璃仪器 ③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管 ④装标准溶液和待测液并调整液面(记录初读数) ⑤取一定体积的待测液于锥形瓶中 ⑥滴定操作
A. ①③②④⑤⑥ B. ①②③④⑤⑥
C. ②③①④⑤⑥ D. ④⑤①②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:I2+2S2O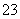 ===S4O
===S4O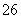 +2I-
+2I-
相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入____ ____,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=__ ______。过滤后,将所得滤液低温蒸发、浓缩结晶,可得CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是(用化学方程式表示)_________________ ____________。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是_________ ___________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用______ __作滴定指示剂,滴定终点的现象是__________________ ____。
②CuCl2溶液与KI反应的离子方程式为__________ ________________。
③该试样中CuCl2·2H2O的质量百分数为____ ____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com