
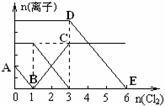
 向含有Fe2+、I━、Br━的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法不正确的是 ( )
向含有Fe2+、I━、Br━的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法不正确的是 ( )
A.线段BC代表Fe3+ 物质的量的变化情况
B.原混合溶液中n(FeBr2)= 6mol
C.当通入Cl2 2mol时,溶液中已发生的离子反应可表示为: 2Fe2++2I━+2Cl2=2Fe3++I2+4Cl━
D.原溶液中n(Fe2+): n(I━): n(Br━)=2:1:3
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列说法正确的是( )
A.1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA个电子
B.1 mol Al分别放入足量的冷的浓HNO3、稀HNO3中,反应后转移的电子均为3NA
C.各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA
D.24 g镁与足量的盐酸或NaOH溶液反应转移的电子数目均为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
苯环结构中,不存在单双键交替结构,可以作为证据的事实是
①苯不能使酸性KMnO4溶液褪色 ②苯分子中碳原子间的距离均相等 ③苯能在一定条件下跟H2加成生成环已烷 ④经实验测得邻二甲苯仅一种结构 ⑤苯在FeBr3存在条件下与液溴发生取代反应,但不因化学变化而使溴水褪色
A.②③④⑤ B.①②③④ C.①②④⑤ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
A.稀硫酸不具有氧化性 B.NH4Cl中只含有离子键
C.可用丁达尔效应区分溶液和胶体 D.金属阳离子被还原时一定得到金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验过程中,始终无明显现象的是( )
A. NO2通入FeSO4溶液中 B. CO2通入CaCl2溶液中
C. NH3通入AlCl3溶液中 D. SO2通入已酸化的Ba( NO3 )2溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
下列相关反应的离子方程式书写正确的是( )
A.4molFe 在5molCl2中点燃反应:5Cl2+4Fe=2FeCl2+2FeCl3
B.氯化铁溶液中通入硫化氢:2Fe3++H2S=2Fe2++S↓+2H+
C.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:
2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种元素的原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍。请回答下列问题:
(1)F的基态原子价电子排布式为 。
(2)B、C、D、E的原子的第一电离能由小到大的顺序为 (用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是
A.分子中都含有σ键和π键
B.中心原子都sp杂化
C.都是含极性键和非极性键的非极性分子
D.互为等电子体
E.B2A2分子的沸点明显低于A2D2分子
(4)F2+能与BD分子形成[F(BD)4]2+,其原因是BD分子中含有
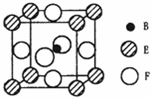 (5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中.与一个F原子距离最近的F原子的数目为 ,该晶体的化学式为 .若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,则该晶体的密度表达式为 。
(5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中.与一个F原子距离最近的F原子的数目为 ,该晶体的化学式为 .若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,则该晶体的密度表达式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有3份等质量的小苏打,第1份直接与过量盐酸反应;第2份先加热,使其部分分解后,再与过量盐酸反应;第3份先加热,使其完全分解后,再与过量盐酸反应。假若盐酸的物质的量浓度相同,实际消耗盐酸的体积分别为V1、V2和V3,则V1、V2和V3的大小关系正确的是
A.V1>V2>V3 B. V1>V3>V2 C. V2>V3>V1 D. V1=V2=V3
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ. 过氧化氢(H2O2)的水溶液俗称双氧水,近年来倍受人们的青睐,被称为“绿色氧化剂”。
(1)写出H2O2的电子式_________________
(2)你认为H2O2被称为“绿色氧化剂”的主要原因是______________________________
(3)将双氧水加入用盐酸酸化的FeCl2溶液中,溶液由浅绿色变为棕黄色,写出该反应的离子方程式为_________________________________,反应中H2O2作_____________剂
(4)双氧水能使酸性高锰酸钾溶液褪色,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里:
MnO4-+___H2O2+_____H+ ===_____Mn2++____H2O+ 。
Ⅱ. 某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程:H2O2→ O2
⑴该反应的化学方程式为________________________________________________________
⑵如反应转移了0. 3mol电子,则产生的气体在标准状况下体积为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com