
【题目】CS2是一种常见溶剂,还可用于生产人造粘胶纤维等。回答下列问题:
(1)CS2与酸性KMnO4溶液反应,产物为CO2和硫酸盐,该反应中还原剂与氧化剂的物质的量之比为 _______(MnO4-被还原为Mn2+)
(2)甲烷硫磺法制取CS2的反应为CH4(g)+2S2(g)![]() CS2(g)+2H2S(g) △H。
CS2(g)+2H2S(g) △H。
① 在恒温恒容密闭容器中进行该反应时,能说明该反应已达到平衡状态的是_______(填字母)
A.v正(S2)=2v逆(CS2)
B.容器内气体的密度不再随时间变化
C.容器内气体的总压强不再随时间变化
D.单位时间内断裂C-H键数目与断裂H—S键数目相等
②已知下列键能数据:
共价键 | C—H | S=S | C=S | H—S |
律能/kJmol-1 | 411 | 425 | 573 | 363 |
该反应的△H _______kJmol-1
(3)在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S):n(CH4)=2:1,发生反应:CH4(g) +2H2S(g)CS2(g) + 4H2(g)。0.1MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
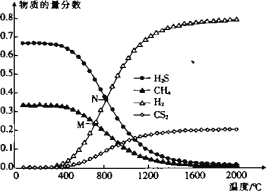
①该反应△H _______(填“>”或“<”)0。
②M点,H2S的平衡转化率为_______,为提高H2S的平衡转化率,除改变温度外,还可采取的措施是_______(列举一条)。
③N点,平衡分压p(CS2)=_______MPa,对应温度下,该反应的KP =_______(MPa)2。(KP为以分压表示的平衡常数)
【答案】5:16 AD -104 > 20% 减小起始时![]() 9.1×10-3 6.6×10-4
9.1×10-3 6.6×10-4
【解析】
(1)CS2中C为+4价,S为-2价,所以与高锰酸钾反应时,变价元素分别是S和Mn,通过升降价守恒计算可得,还原剂和氧化剂的物质的量之比为![]() ;
;
(2)①A.当v正(S2)=2v逆(CS2)时,正逆反应速率相等,所以能证明反应达到平衡状态,A项正确;
B.反应![]() ,全为气体参与,且在恒温恒容条件下反应,根据公式ρ=
,全为气体参与,且在恒温恒容条件下反应,根据公式ρ=![]() ,可知气体密度恒定,所以密度不变不一定平衡,B项错误;
,可知气体密度恒定,所以密度不变不一定平衡,B项错误;
C.反应![]() 气体总物质的量恒定,由公式
气体总物质的量恒定,由公式![]() 可知,体系内压强恒定,所以压强不变不一定平衡,C项错误;
可知,体系内压强恒定,所以压强不变不一定平衡,C项错误;
D.当单位时间内断裂C-H键数目与断裂H—S键数目相等时,正逆反应速率相等,反应一定处于平衡状态,D项正确;
答案选AD。
②由键能计算焓变的公式为ΔH=反应物总键能-生成物总键能,所以代入数据计算后该反应的ΔH=-104kJ/mol;
(3)①根据图像,随着温度升高,反应物H2S的量逐渐下降,所以反应是吸热反应,所以ΔH>0;
②M点时,CH4与H2的物质的量分数相等,列三段式:
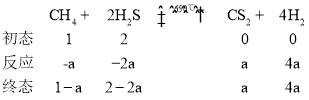 ,所以有1-a=4a,a=0.2,那么H2S的转化率为
,所以有1-a=4a,a=0.2,那么H2S的转化率为![]() ;为提高硫化氢转化率,从平衡移动的角度分析还可以加压或者增加CH4的进料提高CH4与H2S的比例;
;为提高硫化氢转化率,从平衡移动的角度分析还可以加压或者增加CH4的进料提高CH4与H2S的比例;
③N点时,硫化氢与氢气的物质的量分数相同,列三段式:
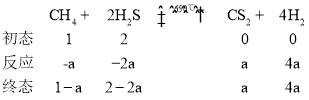 ,所以2-2a=4a,a=
,所以2-2a=4a,a=![]() ,即N点时二硫化碳的物质的量分数为:
,即N点时二硫化碳的物质的量分数为: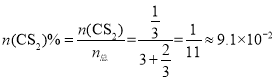 ,所以
,所以![]() ;通过三段式可知
;通过三段式可知![]() ,
,![]() ,所以
,所以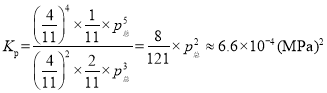 。
。


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了日本吉野彰等三人,以表彰他们对锂离子电池研发的卓越贡献。
(1)工业中利用锂辉石(主要成分为LiAlSi2O6,还含有FeO、CaO、MgO等)制备钴酸锂(LiCoO2)的流程如图:
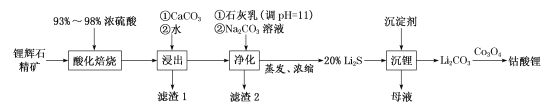
回答下列问题:
①锂辉石的主要成分为LiAlSi2O6,其氧化物的形式为___。
②为提高“酸化焙烧”效率,常采取的措施是___。
③向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为___。(已知:,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.0×10-33,完全沉淀后离子浓度低于1×l0-5)mol/L)。
④“滤渣2”的主要化学成分为___。
⑤“沉锂”过程中加入的沉淀剂为饱和的___(化学式)溶液。
(2)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LiCoO2+C6![]() LixC6+Li1-xCoO2其工作原理如图2。下列关于该电池的说法正确的是___(填字母)。
LixC6+Li1-xCoO2其工作原理如图2。下列关于该电池的说法正确的是___(填字母)。
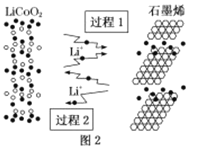
A.过程1为放电过程
B.该电池若用隔膜可选用质子交换膜
C.石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
D.充电时,LiCoO2极发生的电极反应为LiCoO2-xe-=xLi++Li1-xCoO2
E.对废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收
(3)LiFePO4也是一种电动汽车电池的电极材料,实验室先将绿矾溶解在磷酸中,再加入氢氧化钠和次氯酸钠溶液反应获得FePO4固体。再将FePO4固体与H2C2O4和LiOH反应即可获得LiFePO4同时获得两种气体。
①写出FePO4固体与H2C2O4和LiOH反应溶液获得LiFePO4的化学方程式___。
②LiFePO4需要在高温下成型才能作为电极,高温成型时要加入少量活性炭黑,其作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种有机物A的质谱图和红外光谱图如图,以下说法正确的是( )
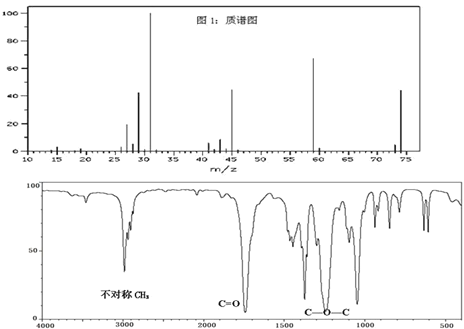
A.由质谱图可知,有机物A的摩尔质量为74
B.由红外光谱可知,有机物A的分子式C3H6O2
C.有机物A的核磁共振氢谱图中有3种吸收峰,峰面积之比为1:2:3
D.有机物A的名称为甲酸乙酯,官能团为酯基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂硫胺(Cinanserin)是上世纪70年代用于抗精神分裂症的药物,对冠状病毒3CL水解酶具有抑制作用,下图是其合成路线图。

已知以下信息:
①A为常见的烃,它对H2的相对密度为39
②2RCOOH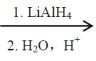 RCH2OH
RCH2OH
③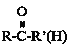 +HCN
+HCN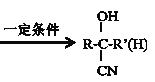
回答下列问题:
(1)A的名称__________;B的结构简式___________;肉桂硫胺中含氧官能团的名称__________。
(2)步骤①的反应方程式________________,其反应类型为_________。
(3)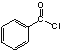 中共平面的原子最多________个。
中共平面的原子最多________个。
(4)M是C的同分异构体,符合下列条件的M有_______种。
①属于芳香族化合物。②能发生银镜反应。
(5)参照题干,写出由![]() 制备
制备![]() 的流程图。_______。
的流程图。_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为前四周期元素,原子序数依次增大,A、D同主族,A2—和B+具有相同的电子层结构;C、E为同周期元素,C核外电子总数是最外层电子数的3倍;E元素最外层有一个未成对电子;F的最外层只有1个电子,但次外层有18个电子。
请回答下列问题:
(1)基态F原子的核外电子排布式为______,F元素在周期表中的位置______,F2+能与足量氨水反应得到深蓝色透明溶液,该深蓝色离子的结构式为______。
(2)六种元素中电负性最小的是______,其中C、D、E的第一电离能由大到小的顺序为______(填元素符号)。
(3)A、D的简单氢化物中沸点较高的物质是______(填化学式),原因是______。
(4)C和E的单质反应可生成组成比为1:3的化合物,该化合物的立体构型名称为 ______,中心原子的杂化轨道类型为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种解毒药,用于氟化物、砷、汞、铅、锡、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症.硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生S和SO2
实验I:Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示:

(1)仪器a的名称是_______,仪器b的名称是_______。b中利用质量分数为70%80%的H2SO4溶液与Na2SO3固体反应制备SO2反应的化学方程式为_______。c中试剂为_______
(2)实验中要控制SO2的生成速率,可以采取的措施有_______ (写出一条)
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是_______
实验Ⅱ:探究Na2S2O3与金属阳离子的氧化还原反应。
资料:Fe3++3S2O32-Fe(S2O3)33-(紫黑色)
装置 | 试剂X | 实验现象 |
| Fe2(SO4)3溶液 | 混合后溶液先变成紫黑色,30s后几乎变为无色 |
(4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过_______(填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅱ的现象:_______
实验Ⅲ:标定Na2S2O3溶液的浓度
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294gmol-1)0.5880g。平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+ = 3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应I2+2S2O32- = 2I- + S4O62-,三次消耗 Na2S2O3溶液的平均体积为25.00 mL,则所标定的硫代硫酸钠溶液的浓度为_______molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六氟化硫(SF6)分子为正八面体构型(分子结构如图所示),难溶于水,在高温下仍有良好的绝缘性,在电器工业方面具有广泛用途。下列推测正确的是( )
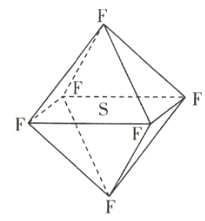
A.SF6各原子均达到最外层8电子稳定结构
B.SF6易燃烧生成SO2
C.SF6分子是含有极性键的非极性分子
D.SF6是原子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种芳纶纤维的拉伸强度比钢丝还高,可广泛用作防护材料。该高分子化合物的结构片段如图所示。下列说法正确的是( )
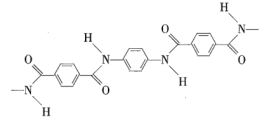
A.羊毛与芳纶纤维的主要化学成分相同
B.该高分子化合物的结构简式为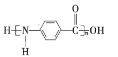
C.该高分子化合物完全水解产生的单个分子中,每个分子苯环上的氢原子都具有不同的化学环境
D.通过质谱法测定芳纶纤维的平均相对分子质量,可得其聚合度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应路线及所给信息填空。

(1)烃A的结构简式是___________,名称是___________________。
(2)①的反应类型是:_____________。③的反应类型是:______________。
(3)反应④的化学方程式是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com