
| 反应过程 | 化学方程式 | 焓变△H(kJ/mol) | 活化能Ea(kJ/mol) |
| 甲烷氧化 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽重整 | CH4(g)+H2O(g)=CO(g)+3H2(g) | 206.2 | 240.1 |
| CH4(g)+2H2O(g)=CO2(g)+4H2(g) | 165.0 | 243.9 |
| p3(H2)?P(CO) |
| P(CH4)?P(H2O) |
| p3(H2)?P(CO) |
| P(CH4)?P(H2O) |

| p3(H2)?P(CO) |
| P(CH4)?P(H2O) |
| p3(H2)?P(CO) |
| P(CH4)?P(H2O) |
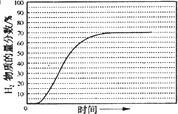 ,
, ;
;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| AlO | - 2 |
| SiO | 2- 3 |
| SO | 2- 3 |
| CO | 2- 3 |
| SO | 2- 4 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2012?浙江模拟)学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.
(2012?浙江模拟)学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.

查看答案和解析>>
科目:高中化学 来源:2012-2013学年新课标高三配套月考(四)化学试卷(A卷)(解析版) 题型:选择题
.[2012·浙江卷] 水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子。某同学对该溶液进行了如下实验:

下列判断正确的是( )
A.气体甲一定是纯净物
B.沉淀甲是硅酸和硅酸镁的混合物
C.K+、AlO2-和SiO32-一定存在于溶液X中
D.CO32-和SO42-一定不存在于溶液X中
查看答案和解析>>
科目:高中化学 来源:2013届新课标高三配套月考(四)化学试卷(A卷)(带解析) 题型:单选题
.[2012·浙江卷] 水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子。某同学对该溶液进行了如下实验: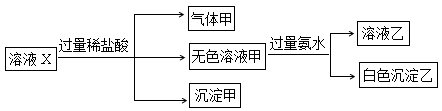
下列判断正确的是( )
| A.气体甲一定是纯净物 |
| B.沉淀甲是硅酸和硅酸镁的混合物 |
| C.K+、AlO2-和SiO32-一定存在于溶液X中 |
| D.CO32-和SO42-一定不存在于溶液X中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com