
| A. | H2反应速率3 mol•l-1•min-1 | B. | N2反应速率0.3 mol•l-1•s-1 | ||
| C. | H2反应速率0.3mol•l-1•s-1 | D. | NH3反应速率0.4mol•l-1•s-1 |
科目:高中化学 来源: 题型:选择题
| A. | Cu2++2Ag═Cu+2Ag+ | B. | CaCO3+2H+═Ca2++CO2↑+H2O | ||
| C. | 2Fe+6H+═2Fe3++3H2↑ | D. | Ba(OH)2+2H+═Ba2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是两种或两种以上的物质发生的反应都属于化合反应 | |
| B. | 在反应中,不一定所有元素的化合价都发生变化 | |
| C. | 一种元素被氧化,一定有另一种元素被还原 | |
| D. | 物质只有和氧气发生反应才是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用葡萄糖制镜或保温瓶胆 | B. | 用Na2S除去废水中的Hg2+ | ||
| C. | 用Na2SiO3溶液制备木材防火剂 | D. | 用K2FeO4作为高效水处理剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 羰基硫与烧碱溶液反应生成水和两种正盐的离子方程式为COS+4NaOH=Na2S+Na2CO3+2H2O羰基硫的脱硫常用两种方法,其反应式分别为:
羰基硫与烧碱溶液反应生成水和两种正盐的离子方程式为COS+4NaOH=Na2S+Na2CO3+2H2O羰基硫的脱硫常用两种方法,其反应式分别为:| 化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
| 键能(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | mmolCO2、3mmolH2、 nmolCH3OH(g)、nmolH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
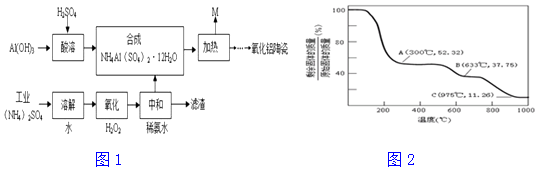
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com