
科目:高中化学 来源: 题型:阅读理解
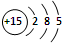
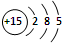
| 2aV1-bV2 |
| 2000 |
| 2aV1-bV2 |
| 2000 |
| 0.01mol?L-1 KIO3酸性溶液(含淀粉)的体积/mL |
0.01mol?L-1 Na2SO3溶液的体积/mL |
H2O的体积 /mL |
实验 温度 /℃ |
溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:


| aV1-0.5bV 2 |
| 1000 |
| aV1-0.5bV 2 |
| 1000 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省信阳高中高一下学期期中考试化学试卷(带解析) 题型:实验题
(15分)I.磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是 。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500°C生成白磷,反应为:
2Ca3(PO4)2+6SiO2==6CaSiO3+P4O10 , 10C+P4O10==P4+10CO
每生成 1molP4时,就有 mol电子发生转移。
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2 用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2===C6H6O6+2H++2I- 2S2O32-+I2===S4O62-+2I-
在一定体积的某维生素C溶液中加入amolL-1I2溶液V1ml,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗bmolL-1 Na2S2O3溶液V2ml.该溶液中维生素C的物质量是 mol。
(4)在酸性溶液中,碘酸钠(KIO3)和亚硫酸钠可发生如下反映:
2IO3-+5SO32-+2H+==I2+5SO42++H2O
生成的碘可以用淀粉液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
| | 0.01mol·L-1KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol·L-1Na2SO3溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液出现蓝色时所需时间/s |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 | |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省无锡市高三上学期期末考试化学试卷 题型:填空题
(12分)本题有A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.(1)偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。试回答下列问题:
①Ti元素在元素周期表中的位置是 ;其基态原子的
电子排布式为 。
②偏钛酸钡晶体中晶胞的结构示意图如右图,它的化学式是 ;晶体内与每个“Ti”紧邻的氧原子数为 个。
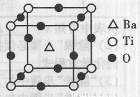
(2)氰气[(CN)2]无色、剧毒、有苦杏仁味,和卤素单质性质相似。已知氰分子中键与键之间的夹角为180。,并有对称性,其结构式为 ,与CN一互为等电子体的单质的分子式为 。
B.某课题小组同学测量液态奶含氮量的实验过程如下:

步骤:
①在烧杯中加入10.00mL液态奶和辅助试剂,加热
充分反应;
②将反应液转移到大试管中;
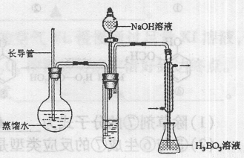
③按右图装置用水蒸气将NH3吹出,并用H3BO3溶液吸收(加热装置未画出);
④取下锥形瓶,滴加指示剂,用0.1000mol·L-1盐酸
标准液滴定;
⑤重复测定数次,再用10.00mL蒸馏水代替液态奶进
行上述操作。
数据记录如下:

回答下列问题:
(1)滴定时(NH4)2B4O7重新转化为H3BO3,反应的离子方程式为 。
(2)步骤③的实验装置中需要加热的仪器是 (填仪器名称),长导管的作用是 。
(3)不做空白对照实验对实验结果有何影响 (填“无影响”,或“偏高”,或“偏低”)。
(4)计算10.00mL液态奶中的含氮量应代人计算的盐酸体积是 mL,该液态奶的含氮量 mg·mL-1。
查看答案和解析>>
科目:高中化学 来源:2011年普通高等学校招生全国统一考试化学卷(福建) 题型:填空题
I.磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是 。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500°C生成白磷,反应为:
2Ca3(PO4)2+6SiO2==6CaSiO3+P4O10 10C+P4O10==P4+10CO
每生成 1molP4 时,就有 mol电子发生转移。
(3)硫代硫酸钠(Na2S2O2)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素 完全氧化,剩余的I2 用Na2S2O2溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2===C6H6O6+2H++2I- 2S2O32-+I2===S4O62-+2I-
在一定体积的某维生素C溶液中加入amolL-1I2溶液V1ml,充分反应后,用Na2S2O2溶液滴定剩余的I2,消耗bmolL-1 Na2S2O2溶液V2ml.该溶液中维生素C的物质量是 mol。
(4)在酸性溶液中,碘酸钠(KIO3)和亚硫酸钠可发生如下反映:
2IO3-+5SO32-+2H+==I2+5SO42++H2O
生成的碘可以用淀粉液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
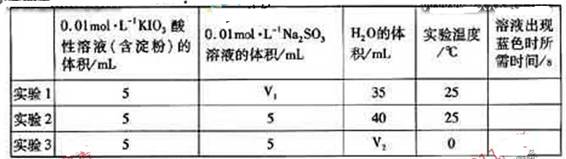
该实验的目的是______;表中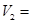 ______ML。
______ML。
II 稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)钵(Ce)是地壳中含量最高的稀土元素,在加热条件下CeCl3易发生水解,无水CeCl3,可用加热CeCl3• 6H2O和NH4Cl固体混合物的方法来制备。其中,NH4Cl的作用是___________。
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH ≈3. Ce5+通过下列反应形成Ce
(OH)4沉淀得以分离。完成反应的离子方程式:
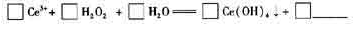
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com