
某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算。实验中加热至恒重的目的是 。
(2)方案二:按下图装置进行实验。并回答以下问题。
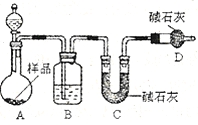
① 实验前先 。分液漏斗中应该装 (“盐酸”或“硫酸”)。D装置的作用是 。
② 实验中除称量样品质量外,还需称 装置前后质量的变化。
③ 根据此实验得到的数据,测定结果有误差。因为实验装置还存在一个明显缺陷,该缺陷是 。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液。过滤洗涤,干燥沉淀,称量固体质量,计算:
① 过滤操作中,除了烧杯,漏斗外,还用到的玻璃仪器有 。
② 实验中判断沉淀是否完全的方法是 。
③ 已知称得样品21.2g,干燥的沉淀质量为19.7g,则样品中碳酸钠的质量分数为 。
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
有关合金的叙述错误的是 ( )。
A.铁与非金属氯、氧等很难形成合金
B.合金是混合物
C.合金具有固定的熔点
D.形成合金后,其熔点比各成分的熔点都高
查看答案和解析>>
科目:高中化学 来源: 题型:
将氨水滴加到盛有AgCl浊液的试管中,AgCl逐渐溶解,再加入NaBr溶液又产生了浅黄色沉淀。对上述过程,下列理解或解释中正确的是( )
A.Ksp(AgCl)<Ksp(AgBr)
B.若在AgCl浊液中直接加入NaBr溶液,也会产生浅黄色沉淀
C.上述实验说明AgCl没有NaBr稳定
D.因为Ksp(AgCl)>Ksp(AgOH),故氨水能使AgCl溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2FeO4是一种高效多功能水处理剂, 应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是
应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是
A.Na2O2只作氧化剂
B.Na2FeO4既是氧化产物又是还原产物
C.O2是还原产物
D.2 mol FeSO4发生反应时,反应中共有8 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物A、B、C、D、E、F的转化关系如下:
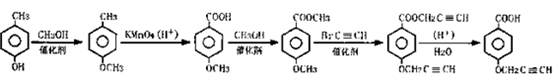
A B C D E F
(1)化合物D中含氧官能团有 、 (填名称)。
、 (填名称)。
(2)鉴别化合物E和F最适宜的试剂是 。化合物D到E的反应类型是 。
(3)化合物A最多有 个原子共平面。
(4)D的同分异构体很多,符合下列条件的同分异构体有____种。
①苯的衍生物且能使FeCl3溶液显紫色;②含有一个羧基;③分子中无甲基
查看答案和解析>>
科目:高中化学 来源: 题型:
现有Na2SO3、Na2SO4混合物样品ag,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是
A.将样品配制成溶液V1L,取其中25.00mL用标准KMnO4溶液滴定,消耗标准KMnO4溶液V2mL
B.向样品中加足量H2O2,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为bg
C.将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为cg
D.将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHSO3的洗气瓶、盛有浓H2SO4的洗气瓶、盛有碱石灰的干燥管I、盛有碱石灰的干燥管II,测定干燥管I增重dg
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是KNO3 、NaCl在不同温度下的部分溶解度数据,请回答问题:
| 温度(℃) | 10 | 20 | 40 | 60 | 80 |
| KNO3 | 20.9 | 31.6 | 63.9 | 110 | 169 |
| NaCl | 35.8 | 36 | 36.6 | 37.3 | 38.4 |
(1)40℃时,将70gKNO3固体加入100g水中,充分搅拌,形成的溶液质量为 g。
(2)60℃时,KNO3的饱和溶液中含有少量NaCl,可通过 方法获得较纯净的KNO3晶体。
(3)t℃时,NaCl和KNO3的饱和溶液溶质质量分数相同,该温度范围是 。
A.10℃~20℃ B.20℃~40℃ C.40℃~60℃ D.60℃~80℃
(4)向20mL水中溶解一定量KNO3固体的操作如下图:请根据实验现象和溶解度数据回答:A、B、C中溶液一定不饱和溶液的是 。当x = g时,B中恰好没有固体剩余。
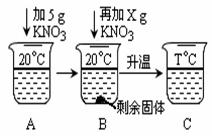

查看答案和解析>>
科目:高中化学 来源: 题型:
在一个容积固定为2 L的密闭容器中,发生反应:aA(g)+bB(g) pC(g) ΔH=?反应情况记录如下表:
pC(g) ΔH=?反应情况记录如下表:
| 时间 | c(A)/mol·L-1 | c(B)/mol·L-1 | c(C)/mol·L-1 |
| 0 min | 1 | 3 | 0 |
| 第2 min | 0.8 | 2.6 | 0.4 |
| 第4 min | 0.4 | 1.8 | 1.2 |
| 第6 min | 0.4 | 1.8 | 1.2 |
| 第8 min | 0.1 | 2.0 | 1.8 |
| 第9 min | 0.05 | 1.9 | 0.3 |
请仔细分析,根据表中数据,回答下列问题:
(1)第2 min到第4 min内A的平均反应速率v(A)=______mol·L-1·min-1。
(2)由表中数据可知反应在第4 min到第6 min时处于平衡状态,若在第2 min、第6 min、第8 min时分别改变了某一反应条件,则改变的条件分别可能是:
①第2 min_________________或________________;
②第6 min_________________;
③第8 min_________________。
(3)若从开始到第4 min建立平衡时反应放出的热量为235.92 kJ,则该反应的ΔH=__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com