
| A. | 同一原子中,轨道的能量高低:1s>2s>3s>4s | |
| B. | 同一原子中,轨道的能量高低:3s<3p<3d | |
| C. | 不同能级中含有的原子轨道数:s-2;p-6;d-10 | |
| D. | M层上所具有的原子轨道数共有9个 |
分析 A.形状相同的原子轨道能量的高低:1s<2s<3s<4s…;
B.相同电子层上原子轨道能量的高低:ns<np<nd<nf;
C.不同能级中含有的原子轨道数:s-1;p-3;d-5;
D.M层有s、p、d能级,s能级有1个轨道、p能级有3个轨道、d能级有5个轨道.
解答 解:A.同一原子中,轨道的能量高低:1s<2s<3s<4s,故A错误;
B.同一原子中,轨道的能量高低:3s<3p<3d,故B正确;
C.不同能级中含有的原子轨道数:s-1;p-3;d-5,故C错误;
D.M层有s、p、d能级,s能级有1个轨道、p能级有3个轨道、d能级有5个轨道,共9个轨道,故D正确;
故选:BD.
点评 本题考查核外电子排布规律,题目难度中等,本题注意把握构造原理的应用.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:解答题
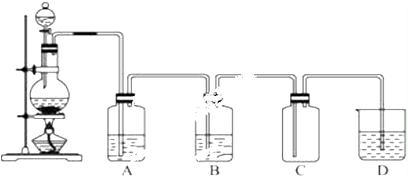
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ②③④⑥ | C. | ①③④⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
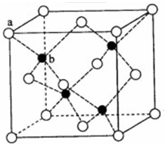 的最简单氢化物的VSEPR模型名称为正四面体,M的最简单氢化物的分子立体构型名称为V形.
的最简单氢化物的VSEPR模型名称为正四面体,M的最简单氢化物的分子立体构型名称为V形. .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物中Fe和Cu的物质的量之比为3:2 | |
| B. | 消耗NaOH溶液体积为260mL | |
| C. | 所得沉淀的质量m=9.83g | |
| D. | 混合物消耗HNO3的物质的量为0.46mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| v正 | v逆 | 平衡常数K | 转化率α |
| [CO2]/mol•L-1 | [H2]/mol•L-1 | [CH4]/mol•L-1 | [H2O]/mol•L-1 | |
| 平衡Ⅰ | a | b | c | d |
| 平衡Ⅱ | m | n | x | y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com