
| A. | 增大压强,活化分子百分数不变,化学反应速率增大 | |
| B. | 升高温度,活化分子百分数增大,化学反应速率增大 | |
| C. | 增大反应物浓度,活化分子百分数增大,化学反应速率增大 | |
| D. | 使用催化剂,活化分子百分数增大,化学反应速率增大 |
分析 增大压强、增大反应物浓度都是增大单位体积内活化分子个数,从而增大有效碰撞几率,所以反应速率增大;升高温度、使用催化剂是增大活化分子百分数,从而增大有效碰撞几率,反应速率增大.
解答 解:A.增大压强,增大单位体积内活化分子个数,从而增大有效碰撞几率,导致反应速率增大,故A正确;
B.升高温度,增大活化分子百分数,从而增大有效碰撞几率,导致反应速率增大,故B正确;
C.增大反应物浓度,增大单位体积内活化分子个数,从而增大有效碰撞几率,反应速率增大,故C错误;
D.使用催化剂,增大活化分子百分数,从而增大有效碰撞几率,反应速率增大,故D正确;
故选C.
点评 本题考查化学反应速率影响因素,为高频考点,明确浓度、温度、压强、催化剂对活化分子个数影响还是百分数影响是解本题关键,注意它们之间的区别,题目难度不大.


科目:高中化学 来源: 题型:解答题
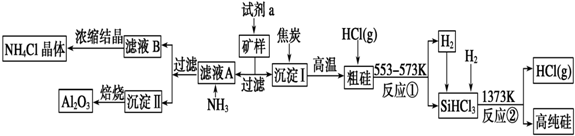

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3 溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| B. | 碳酸的电离方程式:H2CO3?2H++CO32- | |
| C. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3KJ•mol-1 | |
| D. | 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
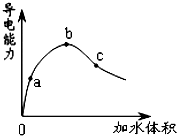 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.下列说法不正确的是( )
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.下列说法不正确的是( )| A. | 在0 点时,醋酸不导电 | |
| B. | a、b、c 三点,a 点时醋酸溶液中氢离子浓度最小 | |
| C. | b 点时,醋酸电离程度最大 | |
| D. | 可通过微热的方法使c 点溶液中c(CH3COO-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗下层液体从活塞放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 蒸发结晶时应将溶液蒸干 | |
| D. | 两种互不相溶,密度也不相同的液体可以用分液漏斗分离,例如苯和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示,回答下列问题
25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示,回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com