
| A. | Ca(OH)2、H2SO4 | B. | Mg(OH)2、H2SO4 | C. | KOH、HCl | D. | Al(OH)3、H3PO4 |
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | K2CO3→KOH | B. | Fe2O3→Fe (OH)3 | C. | Zn→ZnCl2 | D. | MgCl2→Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能发生丁达尔效应的分散系有氯化钠溶液、水等 | |
| B. | 将1 L 2 mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA | |
| C. | 黄河入海口处三角洲的形成与胶体性质有关 | |
| D. | 电泳现象说明胶体带电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素在周期表中的位置如图所示,其中C元素的最高价氧化物对应的水化物浓溶液是一种常见的干燥剂.D在海水中大量富集.E的氧化物是两性氧化物,回答下列问题:
有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素在周期表中的位置如图所示,其中C元素的最高价氧化物对应的水化物浓溶液是一种常见的干燥剂.D在海水中大量富集.E的氧化物是两性氧化物,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
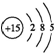 .
.| 0.01mol/LKIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶液 的体积/mL | H2O 的体积 /mL | 实验温 度/℃ | 溶液出现 蓝色时所 需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com