
分析 在水溶液里或融融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不能导电的化合物是非电解质,无论是电解质还是非电解质都必须是化合物,据此分析.
解答 解:①金属铁是金属单质,既不是电解质也不是非电解质;
②氯化铵溶于水电离溶液导电属于电解质;
③硝酸钾溶液属于混合物,是电解质溶液,不是电解质;
④单质碘属于单质,既不是电解质也不是非电解质;
⑤二氧化碳不能电离属于非电解质;
⑥烧碱 是氢氧化钠溶于水导电属于电解质;
⑦硫酸溶于水溶液导电属于电解质;
⑧氧化钙熔融导电属于电解质;
⑨葡萄糖不能电离数非电解质;
⑩食盐水是氯化钠的水溶液,不是电解质,
其中属于电解质的是:②⑥⑦⑧,
属于非电解质的是⑤⑨,
故答案为:②⑥⑦⑧;⑤⑨.
点评 本题考查了电解质和非电解质的概念,题目难度不大,注意电解质和非电解质的区别.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 CO2是一种温室气体,据科学家预测,到21世纪中叶,全球气温将升高1.5-4.5℃,地球气温的升高会引起海平面升高,对人类的生存环境产生巨大的影响.如何合理地利用CO2是摆在科学家面前的一个重大课题.回答下列问题:
CO2是一种温室气体,据科学家预测,到21世纪中叶,全球气温将升高1.5-4.5℃,地球气温的升高会引起海平面升高,对人类的生存环境产生巨大的影响.如何合理地利用CO2是摆在科学家面前的一个重大课题.回答下列问题:| CO2的量 | NaOH溶液的量 | 放出的热量 | |
| ① | 22.0g | 750mL1.0mol•L-1 | xkJ |
| ② | 1.0mol | 2.0mL1.0mol•L-1 | ykJ |
| 物质 | CO2(g) | H2(g) | CH4(g) | H2O(g) |
| 浓度/mol•L-1 | 0.2 | 0.8 | a | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸稀释时应注意将浓硫酸缓缓地倒入盛有水的容量瓶中 | |
| B. | 将11.2L HCl溶于水形成1L溶液,所得溶液的物质的量浓度为0.5mol/L | |
| C. | 0.5mol/L的Na2SO4和1mol/L的NaOH溶液,c(Na+)相同 | |
| D. | 将20g NaOH 溶于1L水中即得到0.5mol/L的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④⑤ | C. | ③④⑤⑥ | D. | ④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
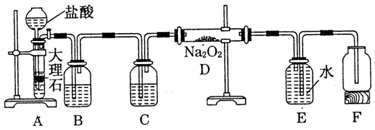
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数Kc | 9.94 | 9 | 1 |
| A | B | C | D | E | |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com