
����Ŀ�����������������Ҫ��������������������й㷺Ӧ�ã����������ж����������γ��������Ҫ���壮������ʵ�����Ʊ����ǹ�ҵ��������������β�����ջ��������dz���Ҫ�����������գ�
��1��ʵ���ҿ���ͭ��Ũ������Ȼ�������������Ʒ�Ӧ��ȡ�������� 
�����������������Ʒ�Ӧ��ȡ��������ϣ���ܿ��Ʒ�Ӧ�ٶȣ���ͼ�п�ѡ�õķ���װ��������д��ĸ����
��2������������������Ʒ�Ӧ��ȡ3.36L����״������������������Ҫ��ȡ��������g������һλС�������������40%�������ƣ��������������������������ƣ����������ȡ����������g ������һλС������
��3��ʵ���Ҷ�������β�������빤ҵ��������Ļ�ѧԭ����ͨ��ʯ�ҩ�ʯ�෨�ͼ�dz��õ���������
ʯ�ҩ�ʯ�෨�����շ�ӦΪSO2+Ca��OH��2��CaSO3��+H2O�����ղ�����������ɹܵ���������������������ӦΪ2CaSO3+O2+4H2O��2CaSO42H2O����������ͼ1��������շ�ӦΪSO2+2NaOH��Na2SO3+H2O������ص����������Ƽ���ǿ�����տ졢Ч�ʸߣ���������ͼ2��
��֪��
�Լ� | Ca��OH��2 | NaOH |
�۸�Ԫ/kg�� | 0.36 | 2.9 |
����SO2�ijɱ���Ԫ/mol�� | 0.027 | 0.232 |
ʯ�ҩ�ʯ�෨�ͼ���ն�������Ļ�ѧԭ����֮ͬ���� �� �ͼ��ȣ�ʯ�ҩ�ʯ�෨���ŵ��� �� ȱ���� ��
��4����ʯ�ҩ�ʯ�෨�ͼ�Ļ����ϣ����һ���Ľ��ġ���ʵ������ѭ��������������������ͼ��ʾ����
���𰸡�
��1��ae
��2��18.9��33.1
��3������SO2���������������Ӧ��ԭ���ã��ɱ��ͣ����������������������ɹܵ�������������������Ч�ʵ�
��4��
���������⣺��1.�������������������ȡ��������Ӧ���ǹ�Һ��ϣ��Ҹ÷�Ӧ����Ҫ���ȣ����Կ��Բ��ù�Һ��ϲ�������װ�ã�ϣ���ܿ��Ʒ�Ӧ�ٶȣ���ʢ��������������뺬�л������ܿ���Һ������������������aeװ�ã���ѡae��
��2.�������غ�ɵã�Na2SO3��SO2 �� ������ȡ�������Ƶ�����Ϊ��m��Na2SO3��=126gmol��1�� ![]() =18.9g��
=18.9g��
��û�б��ʵ���������Ϊ100g������40g�������Ʊ������������ƣ�4g����������Ϊ�����ƺ�������Ϊ��4g�� ![]() =45g������40%�������Ʊ�����Ϊ�����Ƶ���Ʒ���������Ƶ���������Ϊ��
=45g������40%�������Ʊ�����Ϊ�����Ƶ���Ʒ���������Ƶ���������Ϊ�� ![]() ��100%=57.14%��
��100%=57.14%��
��˳�ȡ���ʺ���Ʒ������ӦΪ�� ![]() =33.1g�����Դ��ǣ�18.9��33.1��
=33.1g�����Դ��ǣ�18.9��33.1��
��3.���ҩ�ʯ�෨������SO2��������SO2���������������Ӧ������������SO2�ģ�����������֪���й���Ϣ��֪����ʯ�ҩ�ʯ�෨����ԭ���á��ɱ��͵ȣ��������ղ�����������ɹܵ�����������������������ȱ��Ϊ���������������������ɹܵ�����������������������Ч�ʵͣ����Դ��ǣ�����SO2���������������Ӧ��ԭ���ã��ɱ��ͣ����������������������ɹܵ�������������������Ч�ʵͣ�
��4.�����������ƺ��������Ʒ������ֽⷴӦ����NaOH��Ȼ���ٽ�����������õ���ˮ����ƣ�����NaOH��ѭ�����ã��Ľ��������ͼΪ  ��
��
���Դ��ǣ�  ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һС������Ʒ���ˮ�У�����������ȷ������ ��
A��Na����ˮ���� B��Na��ˮ�����ζ� C��Na����ˮ���� D��Na�ܳɹ���С��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵķе��ɸߵ������е��ǣ� �� ��CH3��CH2��2CH3
��CH3��CH2��3CH3
�ۣ�CH3��3CH
�ܣ�CH3��2CHCH2CH3 ��
A.�ڢܢ٢�
B.�ܢڢۢ�
C.�ܢڢ٢�
D.�ڢܢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Լ��У������ڼ���ƾ����Ƿ���ˮ���ǣ� ��
A. �����ƣ�B. Ũ����C. CuSO4��5H2OD. ��ˮ����ͭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ba(AlO2)2������ˮ����ͼ��ʾ������Al2(SO4)3��Һ����μ���Ba(OH)2��Һʱ�����ɳ��������ʵ���y�����Ba(OH)2�����ʵ���x�Ĺ�ϵ�������й�������ȷ����

A. a��bʱ���������ʵ�����Al(OH)3��BaSO4��
B. d��eʱ��Һ�����ӵ����ʵ�����Ba2�����ܵ���OH��
C. a��dʱ���������ʵ�����BaSO4����С��Al(OH)3
D. c��dʱ��Һ�����ӵ����ʵ�����AlO2����Ba2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������и�ͼ���߱�������Ϣ���ó��Ľ��۲���ȷ���ǣ� �� 
A.ͼ1��ʾ�����������Ϊ10 mL 0.1 molL��1NaOH��Һ����μ���0.1 molL��1 CH3COOH��Һ����Һ��pH�仯���ߣ���b�㴦�У�c��CH3COOH��+c��H+��=c��OH����
B.ͼ2��ʾ��ˮϡ��pH��ͬ������ʹ���ʱ��Һ��pH�仯���ߣ����Т��ʾ���ᣬ���ʾ���ᣬ����Һ�����ԣ�c��b��a
C.ͼ3��ʾH2��O2������Ӧ�����е������仯��H2��ȼ����Ϊ285.8 kJmol��1
D.��ͼ4�ó�����ȥCuSO4��Һ�е�Fe3+ �� �ɲ�������Һ�м�������CuO��������Һ��pH��4����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������
��1�������£�0.1 mol/L NaClO��Һ��pH0.1 mol/L Na2SO3��Һ��pH�� ��ѡ����ڡ�����С�ڡ����ڡ�����Ũ�Ⱦ�Ϊ0.1 mol/L ��Na2SO3��Na2CO3�Ļ����Һ�У�SO32����CO32����HSO3����HCO3�� Ũ�ȴӴ�С��˳��Ϊ ��
��֪��H2SO3 K1=1.54��10��2 K2=1.02��10��7 HClO K1=2.95��10��8
H2CO3 K1=4.3��10��7 K2=5.6��10��11
��2���ñ�����Һ�ζ�����SO2��ˮ��Һ���Բⶨˮ��SO2�ĺ�����Ӧѡ����ָʾ�����ﵽ�ζ��յ�������� ��
��3�������£���amol/lCH3COONa����ˮ�����Һ�������еμӵ����bmolL��1������ʹ��Һ�����ԣ������Ǵ��������Ļӷ������ú�a��b�Ĵ���ʽ��ʾ����ĵ���ƽ�ⳣ��Ka= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪32 g X��40 g Yǡ����ȫ��Ӧ,����m g Q�� 9 g H,����ͬ������,16 g X������Y�������0.25 mol Q������Ħ��H,������Q��Ħ������Ӧ���� ��
A. 122 g��mol-1 B. 63 g��mol-1 C. 126 g��mol-1 D. 163 g��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����MgCl2��AlCl3�Ļ����Һ������μ���NaOH��Һֱ�����������ⶨ�������NaOH�����ʵ���(mol)�����ó��������ʵ���(mol)�Ĺ�ϵ����ͼ��ʾ��
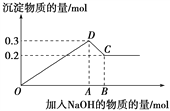
��1��д���������߶η����ķ�Ӧ�����ӷ���ʽ��
OD��________________________________________________��
DC��________________________________________________��
��2��ԭ��Һ��Mg2����Al3�������ʵ���Ũ��֮��Ϊ________��
��3��ͼ��C���ʾ������______mol NaOHʱ��Al3���Ѿ�ת��Ϊ_____��Mg2���Ѿ�ת��Ϊ______��
��4��ͼ���߶�OA��AB��________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com