
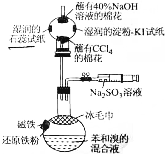
 溴苯是一种化工原料,某课外小组用如图装置改进了苯的溴代反应.
溴苯是一种化工原料,某课外小组用如图装置改进了苯的溴代反应. ,冰毛巾覆盖在圆底烧瓶上半部分的目的是降低温度圆底烧瓶上部温度,起冷却回流作用;
,冰毛巾覆盖在圆底烧瓶上半部分的目的是降低温度圆底烧瓶上部温度,起冷却回流作用;分析 (1)苯与溴易挥发,用四氯化碳吸收;反应生成HBr,用NaOH溶液吸收,防止污染环境;
(2)苯与溴在Fe作催化剂条件下反应生成溴苯与HBr;反应放出热量,溴与苯都易挥发,用冰毛巾覆盖在圆底烧瓶上半部分,降低温度圆底烧瓶上部温度,起冷却回流作用;
(3)亚硫酸钠具有还原性,可以消耗掉未反应的溴;反应中起催化剂作用物质实际是FeBr3,三价铁具有氧化性,可以与亚硫酸钠发生氧化反应生成亚铁离子、硫酸根;溴苯与水溶液不互溶,利用分液的方法进行分离;
(4)利用湿润的淀粉-KI试纸排除溴使湿润的石蕊试变色,再利用湿润的石蕊试纸验证有HBr;
(5)该实验防止环境污染、实验同时可以证明苯和溴发生的是取代反应.
解答 解:(1)苯与溴易挥发,用四氯化碳吸收,防止对环境污染、防止溴对HBr检验的影响,由于反应生成HBr,且易挥发,用NaOH溶液吸收,防止污染环境,
故答案为:吸收挥发苯与溴;吸收HBr,防止污染环境;
(2)苯与溴在Fe作催化剂(实际为溴化铁)条件下反应生成溴苯与HBr,反应方程式为: ;反应放出热量,溴与苯都易挥发,用冰毛巾覆盖在圆底烧瓶上半部分,降低温度圆底烧瓶上部温度,起冷却回流作用,减少原料的损失,
;反应放出热量,溴与苯都易挥发,用冰毛巾覆盖在圆底烧瓶上半部分,降低温度圆底烧瓶上部温度,起冷却回流作用,减少原料的损失,
故答案为: ;降低温度圆底烧瓶上部温度,起冷却回流作用;
;降低温度圆底烧瓶上部温度,起冷却回流作用;
(3)亚硫酸钠具有还原性,可以消耗掉未反应的溴,防止污染环境;反应中起催化剂作用物质实际是FeBr3,三价铁具有氧化性,可以与亚硫酸钠发生氧化反应生成亚铁离子、硫酸根,反应离子方程式为:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;溴苯与水溶液不互溶,从“水洗”后的体系中分离出溴苯的操作是分液,
故答案为:消耗掉未反应的溴,防止污染环境;2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;分液;
(4)湿润的淀粉-KI试纸无明显现象,湿润的石蕊试纸变红色,说明反应生成HBr,可以证明证明苯和溴发生的是取代反应,
故答案为:湿润的淀粉-KI试纸无明显现象,湿润的石蕊试纸变红色;
(5)该实验的优点有:防止造成环境污染、实验同时证明苯和溴发生的是取代反应等,
故答案为:防止造成环境污染、实验同时证明苯和溴发生的是取代反应等.
点评 本题考查制备实验方案,侧重对操作的分析评价考查,明确原理是解题关键,是对学生综合能力的考查,难度中等.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸 | B. | 硝酸 | C. | 氢氧化钠溶液 | D. | 浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | B. | 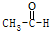 +H2$\stackrel{催化剂}{→}$CH3CH2OH +H2$\stackrel{催化剂}{→}$CH3CH2OH | ||
| C. | H2+Cl2═2HCl | D. | 2CH3CH2OH+O2→2CH3CHO+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com