
| A. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| B. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| C. | 沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 | |
| D. | “血液透析”利用了胶体的性质 |
分析 A.Fe(OH)3胶体的制备方法是:向沸水中滴加少量饱和氯化铁溶液,加热至溶液呈红褐色即可;
B.明矾净水是利用铝离子水解生成氢氧化铝胶体具有吸附悬浮杂质作用;
C.胶体是电中性的分散系;
D.血液是胶体;
解答 解:A.Fe(OH)3胶体的制备方法是:向沸水中滴加少量饱和氯化铁溶液,加热至溶液呈红褐色即可,所以向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体,故A正确;
B.明矾净水是利用铝离子水解生成氢氧化铝胶体具有吸附悬浮杂质作用,所以明矾可用作净水剂,故B正确;
C.氢氧化铁胶体的胶体粒子带有正电荷,但氢氧化铁胶体呈电中性,故C错误;
D.血液是胶体,胶粒不能透过半透膜,故D正确;
故选C.
点评 本题考查胶体性质和制备,主要是胶体微粒、胶体分散系的电性、氢氧化铁胶体制备方法等知识点,题目难度不大.


科目:高中化学 来源: 题型:实验题
 工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=Q kJ•mol-1
工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=Q kJ•mol-1| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
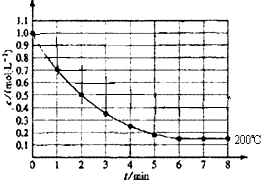 在一密闭容器中放入1molX(g)发生反应:X(g)?4Y(g)+Z(g),如图表示在 200℃时,X的浓度随时间变化的曲线.
在一密闭容器中放入1molX(g)发生反应:X(g)?4Y(g)+Z(g),如图表示在 200℃时,X的浓度随时间变化的曲线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH+3O2$\stackrel{点燃}{→}$2CO2+3H2O | |
| B. | CH3OH+HCl→CH3Cl+H2O | |
| C. | (NH4)2SO4+BaCl2═BaSO4↓+2NH4Cl | |
| D. | CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室盛放碳酸钠溶液的试剂瓶不能用玻璃塞 | |
| B. | 泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将两者混合就可产生大量二氧化碳的泡沫 | |
| C. | 用氯化铵溶液除去铁锈 | |
| D. | 可用碳酸钠与醋酸制取少量二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1 NaHCO3溶液与0.1 mol•L-1 NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| C. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1CH3COOH溶液等体积混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | 0.10mol•L-1CH3COONa溶液中通入HCl至中性,所得溶液中:c(Na+)>c(CH3COOH)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 电离能I(eV) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com