
| 催化剂 |
| 催化剂 |


科目:高中化学 来源: 题型:
| A、1种 | B、2种 | C、3种 | D、4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 点燃 |
| ① | ② | ③ | ④ |

查看答案和解析>>
科目:高中化学 来源: 题型:

| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
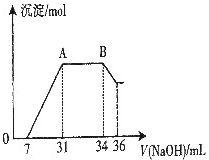 某同学通过查阅资料得知:铝和氧化铁在高温下反应所得到的熔融物应该是铁铝合金.
某同学通过查阅资料得知:铝和氧化铁在高温下反应所得到的熔融物应该是铁铝合金.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去乙烷中含有的乙烯:将气体通入溴水中,洗气 |
| B、检验蔗糖是否水解:取1mL 20%的蔗糖溶液,加3~5滴稀硫酸.水浴加热5min后取少量溶液,加氢氧化钠溶液调溶液pH至碱性,再加入少量新制备的Cu(OH)2,加热3~5 min,观察实验现象 |
| C、除去乙酸乙酯中的乙酸:加入浓硫酸和乙醇,加热 |
| D、鉴别己烯和苯:将溴的四氯化碳溶液分别滴加到少量己烯和苯中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com