
| 0.12mol |
| 0.12L |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
| A、60mL | B、45mL |
| C、30mL | D、75mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
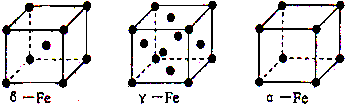
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定质量的镁、铝合金溶于400mL过量的盐酸中,然后在所得溶液中逐滴加入2mol/L氢氧化钠溶液,所得沉淀的物质的量与所加氢氧化钠溶液的体积关系如图:
一定质量的镁、铝合金溶于400mL过量的盐酸中,然后在所得溶液中逐滴加入2mol/L氢氧化钠溶液,所得沉淀的物质的量与所加氢氧化钠溶液的体积关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:
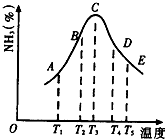 (1)在容积不同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2+3H2?2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如图所示:
(1)在容积不同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2+3H2?2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如图所示:| 物质 | N2 | H2 | NH3 |
| 起始浓度(摩/升) | a | 6 | 0 |
| 转化浓度(摩/升) | b | c | d |
| 平衡浓度(摩/升) | 1 | e | 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com