
【题目】摩尔盐[FeSO4·(NH4)2SO4·6H2O]是一种能溶于水、难溶于酒精的浅蓝绿色晶体,常用于定量分析中配制亚铁离子的标准溶液,实验室用下图所示装置制备摩尔盐。下列说法错误的是
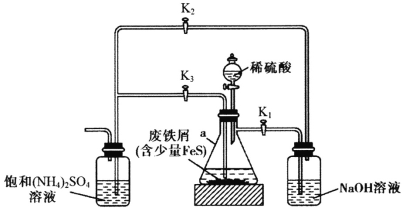
A.铁屑上的少量油污可用煮沸的饱和Na2CO3溶液洗涤,再用蒸馏水洗净
B.用标准摩尔盐滴定酸性KMnO4溶液时不需要外加指示剂
C.实验开始阶段产生的气体是用来排出装置内的空气
D.实验开始时应先打开K1、K3,关闭K2;待a中反应即将完成时,再打开K2,关闭K1
【答案】D
【解析】
A.饱和Na2CO3溶液显碱性,且加热煮沸时,水解程度增大,碱性增强,故铁屑上的少量油污可用煮沸的饱和Na2CO3溶液洗涤,再用蒸馏水洗净,A说法正确;
B.高锰酸钾溶液有颜色,且与亚铁离子反应生成锰离子,故用标准摩尔盐滴定酸性KMnO4溶液时不需要外加指示剂,B说法正确;
C.实验开始阶段产生的气体为氢气和少量硫化氢,硫化氢被NaOH吸收,氢气是用来排出装置内的空气,防止氧化生成的亚铁离子,C说法正确;
D.实验开始时应先打开K1、K2,关闭K3,产生氢气和少量硫化氢,硫化氢被NaOH吸收,氢气是用来排出装置内的空气;待a中反应即将完成时,再打开K3,关闭K1,产生的气体在锥形瓶中聚集,导致压强增大,致使锥形瓶中的液体进入饱和硫酸铵溶液中,D说法错误;
答案为D。


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】某种新型电池放电时的总反应方程式为:![]() ,装置如图。下列说法正确的是
,装置如图。下列说法正确的是![]()
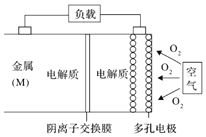
A.放电过程中![]() 通过膜向正极移动
通过膜向正极移动
B.右侧的电极反应式为:![]()
C.若M为Al,则电池放电过程的负极反应式为:![]()
D.在![]() 空气电池中,为防止负极区沉积
空气电池中,为防止负极区沉积![]() ,可改用稀硫酸做电解质溶液
,可改用稀硫酸做电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g) ![]() Fe(s)+CO2(g) △H=a kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是( )
Fe(s)+CO2(g) △H=a kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是( )
A. 若生成1 mol Fe,则吸收的热量小于a kJ
B. 若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动
C. 若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态
D. 达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是( )。
2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是( )。
A. x=1
B. B的转化率为20%
C. 平衡时A的浓度为1.50 mol·L-1
D. 达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)电化腐蚀是钢铁发生腐蚀的主要原因,当水膜氢离子浓度较小时,主要发生________腐蚀,其负极反应式为____________________,正极反应式为______________________。
(2)将氯化铁溶液蒸干灼烧得到的固体物质是______;(填化学式,下同)将硫酸铝溶液蒸干得到的固体物质是___________________ 。
(3)除CaSO4水垢的方法,写出反应的化学方程式_________________、_________________;热的纯碱溶液洗涤效果更好的原理是_________________________;明矾净水的离子方程式__________________。
(4)在2 mL 0.1 mol·L-1的NaCl溶液中,加入2 mL 0.1 mol·L-1的AgNO3溶液,可观察到______________,此反应的离子方程式为_________。将此混合液过滤,滤渣加入2 mL 0.1 mol·L-1的KI溶液,搅拌,可观察到____,反应的离子方程式为________。
(5)对于Ag2S(s)![]() 2Ag+(aq)+S2-(aq),其Ksp的表达式为_______。
2Ag+(aq)+S2-(aq),其Ksp的表达式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KO2从动力学和热力学的角度来说都是稳定的化合物,为电池的长期稳定性提供了可靠依据。K-O2可充电电池可看作金属钾在负极的电镀和剥离与氧气在正极的还原和生成。“界面”用来阻止电解液的持续降解,电解质为二甲醚的二甲基亚砜(DMSO—DME)溶液,能传导K+。电池反应为:K+O2=KO2,装置如下图所示。下列说法错误的是
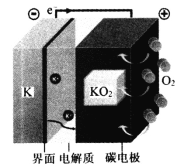
A.放电时,正极反应为K++O2+e-=KO2
B.有效抑制氧气扩散可极大延长K-O2电池的循环性能
C.充电时,每转移1mole-,阳极质量减少39g
D.在理想状态下使用空气来替代纯氧可以降低电池的造价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向某容积恒定的密闭容器中充入1 mol N2、3 mol H2,经充分反应后达到如下平衡:N2(g)+3H2(g)![]() 2NH3(g),下列有关说法中正确的是( )
2NH3(g),下列有关说法中正确的是( )
A. 达平衡后再加入一定量的N2,体系内各物质含量不变
B. N2、H2、NH3的浓度一定相等
C. 反应没有达到平衡时,NH3会不断地分解,达到平衡时则不会再分解
D. 平衡时,N2、H2物质的量之比为1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组在实验室模拟工业制备硫氰化钾(KSCN),实验装置如图所示。
实验步驟如下:

(1)制备NH4SCN溶液:CS2+2NH3![]() NH4SCN+H2S,该反应进行的比较缓慢,NH3不溶于CS2
NH4SCN+H2S,该反应进行的比较缓慢,NH3不溶于CS2
①实验前,应进行的操作是________________________。三颈烧瓶内盛放有一定量的CS2、水和催化剂,三颈烧瓶的下层CS2液体必须浸没导气管口,目的是_____________________。
②实验开始时打开K1,加热装置A、D,缓慢地向装置D中充入气体。装置A中发生反应的化学方程式是______________________________,装置C的作用可能是_______________。
(2)制备KSCN溶液:移去装置A处的酒精灯,关闭K1,打开K2,利用耐碱分液漏斗边加液边加热,则此时装置D中发生反应的化学方程式是____________________。
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩,冷却结晶,__________________,得到硫氰化钾晶体。
(4)测定KSCN的含量:称取10.00g样品配成1000mL溶液,量取20.00mL溶液于锥形瓶中,并加入几滴Fe(NO3)3溶液,用0.1000 mol/L AgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液20.00mL。
①滴定时发生的离子反应为SCN-+Ag+= AgSCN↓,则终点时的现象是________________。
②KSCN的质量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。下列有关说法正确的是( )
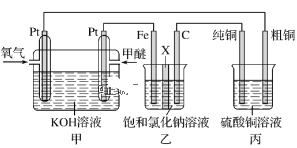
A.反应一段时间后,乙装置中生成的氢氧化钠在铁极区
B.乙装置中铁电极为阴极,电极反应式为Fe-2e-=Fe2+
C.甲中通入氧气的一极为阳极,发生的电极反应为O2+4e-+2H2O=4OH-
D.反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com