
分析 氯气溶于水发生反应Cl2+H2O?HCl+HClO,新制氯水含有Cl2、H2O、HClO、H+、Cl-等粒子,其中Cl2具有黄绿色,而Cl2、HClO具有强氧化性,HClO具有漂白性,溶液中含有Cl-可与硝酸银反应生成白色AgCl沉淀,其中H+可与碳酸氢钠溶液等物质反应,次氯酸见光易分解,所以氯水要避光保存,以此解答该题.
解答 解:A.氯气的颜色是黄绿色,溶液呈淡黄绿色是含有Cl2;
B.氯水中含有氢离子,能与NaHCO3溶液反应生成二氧化碳气体;
C.溶液中含有Cl-,Cl-可与硝酸银反应生成白色AgCl沉淀;
D.氯水中的次氯酸不稳定光照后会分解生成氧气;
E.氯气具有氧化性,能把亚铁离子氧化为铁离子,则氯水滴入浅绿色的FeCl2溶液中,溶液变成黄色,是因为氯气的氧化性;
F.HClO具有漂白性,可使有色物质褪色;
G.氯水滴在蓝色石蕊试纸上氢离子使其变红色,HClO具有漂白性,使其褪色;
H.HClO具有强氧化性,可以用于消毒和漂白;
故答案为:Cl2;H+;Cl-;HClO;Cl2;HClO;H+、HClO;HClO;
(5)新制氯水中的次氯酸不稳定,见光易分解,次氯酸分解得到盐酸和氧气,2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,所以新制的氯水保存方法为:棕色试剂瓶避光保存,
故答案为:棕色试剂瓶避光保存;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.
点评 本题综合考查氯气和氯水的性质,注意把握氯气和水反应的特点以及氯水的成分和性质,为高考高频考点,侧重于基础知识的综合运用,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸溶液反应:2H++CO32-=H2O+CO2 | |
| B. | 铁钉放入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 碳酸氢钠与稀盐酸反应:HCO3-+H+=CO2↑+H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ②④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
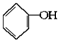 合成
合成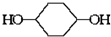 (部分试剂和反应条件已略去).
(部分试剂和反应条件已略去).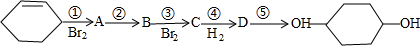
 、D
、D .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O
+2NaBr+2H2O .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
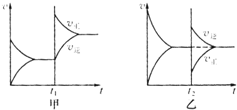 在一定条件下,有反应xA+yB?zC.
在一定条件下,有反应xA+yB?zC.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有②③ | C. | 只有②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | CO、SO2、SO3均是酸性氧化物 | |
| B. | 工业上利用Cl2和澄清石灰水反应来制取漂白粉 | |
| C. | 漂白粉的有效成分为Ca(ClO)2 | |
| D. | 除去与水反应的两个反应,图示其余转化反应均为氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com