
根据原子结构及元素周期律的知识,下列推断正确的是 ( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl‾、S2‾、Ca2+、K+半径逐渐减小
D.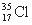 与
与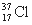 得电子能力相同
得电子能力相同
科目:高中化学 来源: 题型:
29.(18分)在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)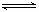 2AB(g) △H<0,反应中各物质的浓度随时间的变化情况如图所示。
2AB(g) △H<0,反应中各物质的浓度随时间的变化情况如图所示。
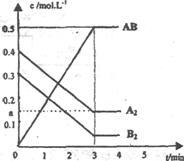 (1)该反应进行到__________min时达到平衡,用AB表示的平均反应速率为: mol/(L.min)(用分数表示)。
(1)该反应进行到__________min时达到平衡,用AB表示的平均反应速率为: mol/(L.min)(用分数表示)。
(2)图中对应的a的数值是_________,该反应的化学平衡常数Kc=__________(保留分数)。温度升高Kc值___________(填“增大”、“减少”或“不变”)。
(3)在上述反应达到平衡后,第4min时,若将容器的体积快速扩大一倍(其他条件不变),请在图中画出4min~5min的AB浓度的变化线。
(4)在相同条件下,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.4mol、0.2mol、0.8mol。则反应向 反应方向进行(填“正”或“逆”)。判断依据是 。反应达到平衡后,各物质的体积分数与原平衡相比___________(填序号)
①A2、B2减小,AB增大 ②A2、B2增大,AB减小 ③均不变 ④无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于电解质溶液的叙述正确的是
A. pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
B. pH相同的盐酸和醋酸溶液,加水稀释100倍后两溶液pH仍相同
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.25 ℃,将pH = 5的盐酸稀释1000倍后,溶液的pH=8
查看答案和解析>>
科目:高中化学 来源: 题型:
为了完成教材上的“中和热的测定”这个实验
(1)实验桌上有烧杯(大、小两个)、泡沫塑料、泡沫塑料板(中心有两个小孔)、环形玻璃搅拌棒,0.50mol·L-1盐酸、0.55mol·L—1NaOH溶液,尚缺少的实验用品是 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?答: (填“能”或“否”)。其原因是 。
(3)实验时所用盐酸及NaOH溶液的体积均为50mL,各溶液密度为1g·cm—3,生成溶液的比热容c=4.18J/(g·℃),实验起始温度为t1℃,终止温度为t2℃。试推断中和热的计算式: 。
(4)如果用50mL的0.60mol·L-1盐酸与50mL 的0.55mol·L—1NaOH溶液进行反应。若热量无损失,与上述实验相比,所求中和热 (填“偏大、偏小、相等”),简述理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关离子键、共价键的叙述中正确的是( )
A.离子化合物中只存在离子键,没有共价键
B.构成非金属单质分子的粒子中一定含有共价键
C.共价化合物分子中一定不存在离子键
D.仅由非金属元素组成的化合物中一定不含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
四种主族元素的离子a X2+,bY+,cZ-和dR2-(a,b,c,d为元素的原子序数),它们具有相同的电子层结构,,对下列叙述的判断正确的是( )
①c-b=2 ②元素的原子序数a>b>c>d
③元素非金属性Z>R ④最高价氧化物对应水化物碱性X>Y
A.②③正确 B.只有③正确 C.①②③④正确 D.①②③正确
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制备硝基苯的方法是将苯与浓硫酸和浓硝酸的混合液加热到55~60 ℃反应,已知苯与硝基苯的基本物理性质如下表所示:
| 熔点 | 沸点 | 状态 | |
| 苯 | 5.51 ℃ | 80.1 ℃ | 液体 |
| 硝基苯 | 5.7 ℃ | 210.9 ℃ | 液体 |
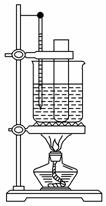
(1)要配制浓硫酸和浓硝酸的混合酸的注意事项是___________________ ________________________________________________。
(2)分离硝基苯和水的混合物的方法是 ;分离硝基苯和苯的方法是__________________________________________________。
(3)某同学用如图装置制取硝基苯:
①用水浴加热的优点是__________________________________________;
②指出该装置的两处缺陷____________________________________________________;
___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有a—h8种短周期元素,它们在元素周期表中的位置如下所示,据此回答问题 :
| a | |||||||||||||||||
| d | e | ||||||||||||||||
| b | c | f | g | h | |||||||||||||
(1)下列元素原子间容易形成离子键的是_______,化学式为__________。 容易形成共价键的是_________,化学式为_________。
A.C和f B.b和h
C.d和h D.b和e
(2)下列分子中所有原子都满足最外层8电子结构的是________
A.ea3 B.bh
C.fh3 D.dh4
(3)均由a、b、g和氧元素形成的两种离子化合物,其中有一物质相对分子质量为120,该化合物融化时破坏的是__________,电离方程式为__________;溶于水时破坏的是__________,电离方程式为__________。均由a、b、g和氧元素形成的该两种离子化合物,相互反应可生成有刺激性气味的气体,则反应的离子方程式为________。(写在电离方程式下一行)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com