
| A. | ①③⑤ | B. | ①②③④ | C. | ①③④⑤ | D. | 只有② |
分析 二氧化硫和水反应生成的亚硫酸和有机色素品红结合成不稳定的无色物质,加热不稳定的物质分解恢复原来的眼神,体现了二氧化硫的漂白性;
①紫红色是高锰酸根离子的颜色,通入二氧化硫气体溶液褪色是二氧化硫把高锰酸根还原为无色的锰离子,不是二氧化硫的漂白性;
②品红溶液褪色,结合无色的大分子化合物而褪色,是二氧化硫的漂白性;
③红棕色褪去的原因是:溴水是红棕色,SO2和Br2、H2O反应,是二氧化硫的还原性,不是二氧化硫的漂白性;
④浅黄绿色褪去的原因是:氯水是浅黄绿色,SO2和Cl2、H2O反应,是二氧化硫的还原性,不是二氧化硫的漂白性;
⑤黄色褪去,是Fe3+的黄色,Fe3+和二氧化硫发生氧化还原反应生成亚铁离子和硫酸,不是二氧化硫的漂白性.
解答 解:①高锰酸钾溶液本身呈紫红色,通入二氧化硫气体,发生氧化还原反应,高锰酸钾把二氧化硫氧化,本身被还原为无色锰离子,体现二氧化硫的还原性,故①不符合;
②品红溶液褪色,结合无色的大分子化合物而褪色,是二氧化硫的漂白性,故②符合;
③二氧化硫气体通入溴水中发生氧化还原反应SO2+Br2+2H2O=H2SO4+2HBr,红棕色退去,体现了二氧化硫的还原性,故③不符合;
④二氧化硫气体通入氯水中发生氧化还原反应SO2+Cl2+2H2O=H2SO4+2HCl,浅绿色退去,体现了二氧化硫的还原性,故④不符合;
⑤黄色褪去,是Fe3+的黄色,Fe3+和二氧化硫发生氧化还原反应生成亚铁离子和硫酸,不是二氧化硫的漂白性;故⑤不符合;
故选D.
点评 本题考查了二氧化硫的还原性、漂白性、酸性氧化物的化学性质,注意利用物质或离子的颜色及发生的化学反应来分析解答,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准).
(1)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准).| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 | 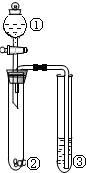 |
| A | 稀盐酸 | 石灰石 | 稀的碳酸钠溶液 | 溶解度:碳酸钠>碳酸氢钠 | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸有脱水性、强氧化性 | |
| C | 浓硫酸 | Na2SO3 | 品红溶液 | 浓硫酸具有强氧化性 | |
| D | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 酸性:盐酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.12 g | B. | 2.24 g | C. | 3.36 g | D. | 6.40 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com