
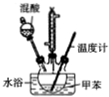
 2-硝基甲苯和4-硝基甲苯均可用于印染行业,实验室利用下列反应和装置制备这两种物质
2-硝基甲苯和4-硝基甲苯均可用于印染行业,实验室利用下列反应和装置制备这两种物质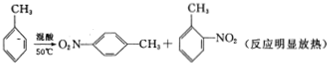
| 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 2-硝基甲苯 | 137 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
| 4-硝基甲苯 | 137 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
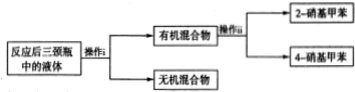
分析 (1)浓硫酸溶于水会放出大量的热,容易发生液体飞溅的情况,同时浓硝酸易挥发,据此确定配制该实验所需混酸的方法;
(2)控制温度,其措施有水浴加热、充分搅拌和控制滴加混酸的速度;操作ii是分离2-硝基甲苯和4-硝基甲苯,可以用蒸馏的方法,据此选择仪器;
产率的计算方法就是用实际产量除以理论产量;根椐方程式,一摩尔的甲苯可以得到一摩尔的对硝基甲苯或一摩尔的邻硝基甲苯,据此可计算出一硝基甲苯的产率;
(4)①取10.00mL稀释液的过程中,酸式滴定管的初始液面为0.20mL,则量取液体最终的刻度应为10.20mL,所以量取过程中眼睛要注视酸式滴定管内液面是否达到10.20mL的刻度;
②滤渣表面可能有的杂质为氯离子,所以可以通过检验是否有氯离子来确定是否洗涤干净;
③混酸中氢离子的总物质的量可以根据氢氧化钠计算,而硫酸的物质的量可以根据生成硫酸钡沉淀的质量计算,进而计算出HNO3的浓度.
解答 解:(1)浓硫酸溶于水会放出大量的热,容易发生液体飞溅的情况,同时浓硝酸易挥发,所以配制混酸的方法是分别量取10 mL和30 mL的浓硫酸和浓硝酸,将浓硝酸倒入烧杯中,浓硫酸沿着烧杯内壁缓缓注入,并不断搅拌,
故答案为:分别量取10 mL和30 mL的浓硫酸和浓硝酸,将浓硝酸倒入烧杯中,浓硫酸沿着烧杯内壁缓缓注入,并不断搅拌;
(2)控制温度,其措施有水浴加热、充分搅拌和控制滴加混酸的速度,操作ii是分离2-硝基甲苯和4-硝基甲苯,可以用蒸馏的方法,所以会用到温度计、锥形瓶,故选ac,20.0mL甲苯的物质的量为$\frac{20×0.866}{92}$mol=0.188mol,理论上产生硝基甲苯的质量为0.188mol×137g/mol=25.76g,所以产率为$\frac{13.7g}{25.76g}$×100%=53.2%,
故答案为:控制滴加混酸的速度;ac;53.2%;
(4)①取10.00mL稀释液的过程中,酸式滴定管的初始液面为0.20mL,则量取液体最终的刻度应为10.20mL,所以量取过程中眼睛要注视酸式滴定管内液面是否达到10.20mL的刻度,其操作为平视10.20mL的刻度线,
故答案为:平视10.20mL的刻度线;
②滤渣表面可能有的杂质为氯离子,所以可以通过检验是否有氯离子来确定是否洗涤干净,其操作为取适量最后一次洗涤液于试管中,加入硝酸银,若不产生白色沉淀,则证明洗涤干净,
故答案为:取适量最后一次洗涤液于试管中,加入硝酸银,若不产生白色沉淀,则证明洗涤干净;
③VmL,0.1000mol•L-1NaOH溶液中NaOH的物质的量为V×10-4 mol,所以原样品中混酸中氢离子的总物质的量为$\frac{100}{10}$×V×10-4 mol=V×10-3 mol,而混酸中硫酸的物质的量为$\frac{10w}{233}$mol,所以混酸中HNO3的物质的量为V×10-3 mol-$\frac{10w}{233}$×2mol,则HNO3的浓度为$\frac{V×1{0}^{-3}mol-\frac{10w}{233}×2mol}{0.01L}$=(0.1V-$\frac{2000w}{233}$)mol/L,
故答案为:0.1V-$\frac{2000w}{233}$.
点评 本题主要考查一硝基甲苯的制备,涉及实验流程、产率的计算、实验基本操作等知识,难度中等,熟悉流程的意义与目的是解题的关键,侧重对学生综合能力的考查.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:解答题
| D | ||
| A | B | C |
| E |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到:
对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到: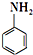 +H2SO4$\stackrel{170-180℃}{→}$
+H2SO4$\stackrel{170-180℃}{→}$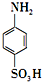 +H2O
+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 9.0 | -- | -- |
| 沉淀完全时的pH | 3.7 | 9.6 | 11.0 | 8(>8溶解) | 9(>9溶解) |

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲烷的熔沸点比硅烷的低 | |
| B. | NH3易液化 | |
| C. | NH3分子比PH3分子稳定 | |
| D. | 在相同条件下,H2O的沸点比H2S的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
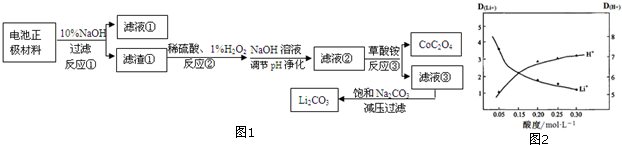
| 弱电解质 | CoC2O4 | Fe(OH)3 | NH3•H2O | H2C2O4 |
| 平衡常数 | Ksp=6.3×10-8 | Ksp=2.79×10-39 | Ka=1.7×10-5 | Ka1=5.6×10-2 Ka2=5.4×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶粒可以透过滤纸,不能透过半透膜 | |
| B. | 采用喷雾型药剂形成一定大小的液珠,可有效提高药物疗效 | |
| C. | 冶金工业的矿粒除尘利用了丁达尔效应 | |
| D. | 空气中的雾压现象体现了胶体的存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com