
 已知A、B、C、D、X、Y、Z七种短周期主族元素的原子序数依次增大,A是元素周期表中原子半径最小的,B的最高价氧化物的水化物与其氢化物反应生成盐,且B的核电荷数比Y的最外层电子数多1.C原子的最外层电子数是次外层电子数的3倍,D原子半径在同周期中除稀有气体外最大,X是同周期中简单离子半径最小的元素.请回答下列问题:
已知A、B、C、D、X、Y、Z七种短周期主族元素的原子序数依次增大,A是元素周期表中原子半径最小的,B的最高价氧化物的水化物与其氢化物反应生成盐,且B的核电荷数比Y的最外层电子数多1.C原子的最外层电子数是次外层电子数的3倍,D原子半径在同周期中除稀有气体外最大,X是同周期中简单离子半径最小的元素.请回答下列问题: ,A与C形成的10电子分子的电子式为
,A与C形成的10电子分子的电子式为 .
.分析 已知A、B、C、D、X、Y、Z七种短周期主族元素的原子序数依次增大,A是元素周期表中原子半径最小的,A为H元素;B的最高价氧化物的水化物与其氢化物反应生成盐,B为N元素,且B的核电荷数比Y的最外层电子数多1,Y为S元素;C原子的最外层电子数是次外层电子数的3倍,C为O元素;D原子半径在同周期中除稀有气体外最大,D为Na,X是同周期中简单离子半径最小的元素,X为Al,结合原子序数Z的最大,则Z为Cl.
(1)B为N元素;
(2)电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小;
(3)Y为S,离子核外电子数为18,A与C形成的10电子分子为水;
(4)利用氢化物的稳定性、化合物中活泼非金属显负价、最高价含氧酸的酸性比较非金属性;
(5)Y、Z两种元素形成的化合物H,H结构与过氧化氢相似,H的结构式为Cl-S-S-Cl;
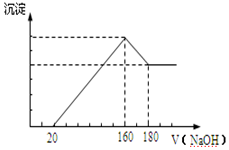
(6)由图可知,Al、Mg与盐酸反应后,盐酸过量,0~20mL发生HCl+NaOH=NaCl+H2O,20mL~160mL时生成Mg(OH)2、Al(OH)3,160-180mL发生Al(OH)3+NaOH=NaAlO2+2H2O,结合反应计算.
解答 解:由上述分析可知,A为H,B为N,C为O,D为Na,X为Al,Y为S,Z为Cl,
(1)B在元素周期表的位置为第二周期VA族,故答案为:第二周期VA族;
(2)电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则离子半径为S2->Cl->O2->Na+,
故答案为:S2->Cl->O2->Na+;
(3)Y的离子结构示意图为 ,A与C形成的10电子分子为H2O,电子式为为
,A与C形成的10电子分子为H2O,电子式为为 ,
,
故答案为: ;
; ;
;
(4)A.常温下,Y的单质呈固态,C的单质呈气态,不能比较非金属性,故A不选;
B.C的氢化物的稳定性强于Y的氢化物,可知非金属性C大于Y,故B选
C.C与Y形成的化合物中,Y呈正价,可知非金属性C大于Y,故C选;
D.C的氢化物的沸点高于Y的氢化物,与水分子间含氢键有关,不能比较非金属性,故D不选;
E、C为O,不存在正价,不能利用最高价氧化物对应的水化物酸性比较非金属性,故E不选;
故答案为:BC;
(5)Y、Z两种元素形成的化合物H,H结构与过氧化氢相似,H的结构式为Cl-S-S-Cl,只含共价键,为共价化合物,6.75g的H中含有的共用电子对数目为$\frac{6.65g}{135g/mol}$×3×NA=0.15NA,
故答案为:共价;0.15NA;
(6)①加入NaOH溶液160-180mL过程中反应的离子方程式为Al(OH)3+OH-═AlO2-+2 H2O,故答案为:Al(OH)3+OH-═AlO2-+2 H2O;
②由图可知,从加入20m氢氧化钠溶液L开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,该阶段消耗氢氧化钠140mL,由氢氧根守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH)=(0.16L-0.02L)×5mol/L=0.7mol.从加入氢氧化钠溶液160mL~180mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.18L-0.16L)×5mol/L=0.1mol,故3×0.1mol+2n[Mg(OH)2]=0.7mol,解得n[Mg(OH)2]=0.2mol,由元素守恒可知n(Mg)=n[Mg(OH)2]=0.2mol,所以Mg的质量为0.2mol×24g/mol=4.8g;
加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH)=0.16L×5mol/L=0.8mol,根据氯元素守恒n(HCl)=0.8mol,故盐酸的物质的量浓度为$\frac{0.8mol}{0.1L}$=8mol/L,
故答案为:4.8;8.
点评 本题考查位置、结构与性质,为高频考点,把握元素的性质、元素化合物知识来推断元素为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ①②④ | C. | ①②⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精可用来消毒是由于其具有强氧化性 | |
| B. | 电能、地热能、生物质能均为一次能源 | |
| C. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| D. | 明矾可用于净水,是因为生成的胶体具有吸附作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某同学的体检报告单显示其血液中葡萄糖含量为4.94mmol/L,mmol/L是物质的量的单位 | |
| B. | 石油是复杂的混合物,通过分馏可以获得汽油、煤油等,通过催化重整可以获得乙烯、丙烯等 | |
| C. | 自然界中的方铅矿(PbS),遇上CuSO4溶液会慢慢变成铜蓝(CuS)说明Ksp(PbS)>Ksp(CuS) | |
| D. | 水玻璃是制备木材防火剂的原料,其主要成分是二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
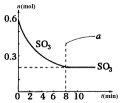 在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2(g)+O2(g)-Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是( )
在一个2L的密闭容器中,发生反应:2SO3(g)?2SO2(g)+O2(g)-Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是( )| A. | 0~8min内v(SO3)=0.025mol/(L•min) | |
| B. | 8min时,v逆(SO2)=2v正 (O2) | |
| C. | 8min时,容器内压强保持不变 | |
| D. | 若8min时将容器压缩为1L,n(SO3)的变化如图中a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热可加快反应速率 | B. | 增大稀硫酸的浓度可加快反应速率 | ||
| C. | 粉碎锌粒可加快反应速率 | D. | 提高锌的纯度可加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用长颈漏斗分离汽油和水的混合液 | |
| B. | 酒精灯使用不当引起少量酒精在桌上燃烧时,立即用湿布盖灭 | |
| C. | 给盛有液体的试管加热时,要不停地移动试管 | |
| D. | 洗净的锥形瓶和容量瓶可用烘箱烘干 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若ρ(甲)<ρ(乙),则气体的压强:甲>乙 | B. | 若ρ(甲)>ρ(乙),则分子数:甲>乙 | ||
| C. | 若ρ(甲)<ρ(乙),则气体摩尔体积:甲<乙 | D. | 若ρ(甲)>ρ(乙),则气体体积:甲<乙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com