
课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,如图是测定装置的示意图,A中的试剂是盐酸。
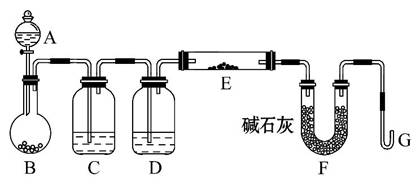
请回答下列问题:
(1)仪器中装入的试剂:
B________、C________、D________;
(2)连接好装置后应首先_______________,其方法_______________________;
(3)“加热反应管E”和“从A逐滴滴加液体”这两步操作应该先进行的是________________________,在这两步之间还应进行的操作是_______________
_________________________________;
(4)反应过程中G管逸出的气体是________,其处理方法是________________
_________________________________。
【解析】(1)实验室制H2,应选择Zn和稀盐酸反应制备,故B中为锌粒。由于B中反应产生的H2中含有HCl和H2O等杂质,因此,先通过盛H2O的洗气瓶除去HCl,再通过盛浓硫酸的洗气瓶除去H2O。
(2)实验前应首先检查装置的气密性,方法是将G弯管插入水中,用酒精灯微热烧瓶B,若观察到G管口有气泡逸出,撤去酒精灯后回升一段水柱则说明气密性良好。
(3)先加入稀盐酸,利用产生的H2将装置中的空气排尽,检验H2的纯度后,再加热反应管E,以免加热发生爆炸。
(4)最后的尾气为H2,H2是一种可燃性气体,因此在G管口处点燃除去。
答案:(1)锌粒 水 浓硫酸
(2)检查装置的气密性 将G弯管末端浸没在盛有水的烧杯(或水槽)中,微热烧瓶B,观察G管口,若有气泡逸出且撤去酒精灯,回升一段水柱,说明装置的气密性良好
(3)从A逐滴滴加液体 检验H2的纯度
(4)氢气 在G管出口处点燃


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
A、B、C、D、E 5种元素,已知:
①A原子最外层电子数是次外层电子数的2倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同。E原子M层上的电子比K层多5个。
②常温下B2是气体,它对氢气的相对密度是16。
③C的单质在B2中燃烧,生成淡黄色固体F。F与AB2反应可生成B2。
④D的单质在B2中燃烧,发出淡紫色火焰,生成有刺激性气味的气体DB2。DB2中D的质量分数为50%。根据以上情况回答:
(1)A是______、B是______、C是______、D是______、E是______(写元素符号)。
(2)E的原子结构示意图__________,C的 离子结构示意图__________。
离子结构示意图__________。
(3)F和AB2反应的化学方程式 ___________________________________________。
___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是
| 实验 | 反应 温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | ||
| A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氢气是一种清洁能源。
(1)已知 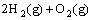 =2H2O(g) △H=- 483.6 kJ/mol
=2H2O(g) △H=- 483.6 kJ/mol
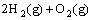 =2H2O(l) △H=-571.6 kJ/mol
=2H2O(l) △H=-571.6 kJ/mol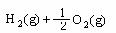
=H2O(l) △H=-285.8 kJ/mol
氢气的燃烧热是 kJ/mol
(2)人们可以通过多种途径获取氢气。
①1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为
②工业上制氢气的一个重要反应是:CO(g)+H2O(g)=CO2(g)+H2(g),已知在25℃时:
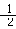 H2 (g) + O2 (g) = H2O(g) △H=-242 kJ/mol
H2 (g) + O2 (g) = H2O(g) △H=-242 kJ/mol
C(石墨)+O2(g)== CO2(g) △H=-394 kJ/mol
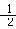 C(石墨)+ O2(g)== CO(g) △H=-111 kJ/mol
C(石墨)+ O2(g)== CO(g) △H=-111 kJ/mol
则25℃时一氧化碳与水蒸气作用转化成氢气和二氧化碳反应的△H= kJ/mol 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D四种元素,其离子A+、B2+、C-、D2-具有相同的电子层结构,下列判断正确的是( )
A. 原子序数由大到小的顺序是:B>A>C>D
B. 离子半径由大到小的顺序是:B2+>A+>C-> D2-
C. A、B、C、D四种元素可能属于同一周期
D. ABCD四种元素一定属于短周期元素
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质的比较顺序中,错误的是( )
A.酸性:HClO4>H2SO4>H3PO4>H2SiO3 B.微粒半径:K+>Na+>Mg2+>Al3+
C.热稳定性:HF<HCl<HBr<HI D.熔点:Li>Na>K>Rb
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在密闭容器中发生反应2NO2 2NO + O2 ,经过一定时间后,测得混合气体中NO2的浓度为0.1mol/L,O2的浓度为0.2mol/L,且各物质的浓度不再发生变化,
求:(1)NO2的起始浓度? (2)此时NO2的分解率?
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列各空:
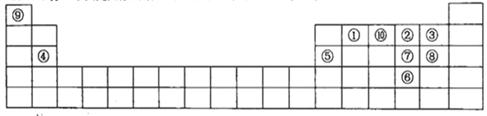
(1)在这10种元素中,非金属性最强的是___________(填序号);
(2)元素②⑧⑨以原子个数比1:1:1形成的化合物的结构式为______________________,元素②与⑨形成的10e-化合物的电子式____________________;
(3)②、⑨、⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M中含有的化学键类型有___________________________;
(4)比较元素⑦⑧形成的气态氢化物的稳定性:____>____(用化学式表示)
(5)元素⑤的氧化物与氢氧化钠溶液反应的离子方程式______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com