
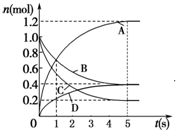
 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A. | 该反应的化学方程式为6A+2 D?3B+4C | |
| B. | 反应进行到1 s时,v(A)=v(B) | |
| C. | 反应进行到5 s时,B的平均反应速率为0.06mol/(L•s) | |
| D. | 反应进行到5 s时,v(A)=v(B)=v(C)=v(D) |
分析 A、根据图象中的有关数据判断四种物质的变化,再根据计量数之比等于物质的量的变化量之比;
B、反应进行到1 s时,A、B的物质的量变化量不等,根据v=$\frac{\frac{△n}{V}}{△t}$来判断;
C、反应进行到5 s时,B的平均反应速率根据v=$\frac{\frac{△n}{V}}{△t}$来计算;
D、平衡状态,v(A):v(B):v(C):v(D)=系数之比.
解答 解:A、由图可知,反应达到平衡时A物质增加了1.2mol、D物质增加了0.4mol、B物质减少了0.6mol、C物质了0.8mol,所以A、D为生成物,物质的量之比为3:1,B、C为反应物,物质的量之比为3:4,反应方程式为:3B+4C?6A+2D,故A错误;
B、反应进行到1 s时,n(A)=n(B),但是A、B的物质的量变化量不等,所以v(A)≠v(B),故B错误;
C、反应进行到5 s时,B的平均反应速率v=$\frac{\frac{1.0mol-0.4mol}{2L}}{5s}$=0.06mol/(L•s),故C正确;
D、反应进行到5 s时达到了平衡状态,v(A):v(B):v(C):v(D)=6:3:4:2,故D错误.
故选C.
点评 本题主要考查了可逆反应的书写、化学平衡的特征、及化学反应的计算,本题解题的关键是根据图象找出相关信息,对学生的识图能力有一定的要求,中等难度.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | HC≡CCH(CH3)C(CH3)3 | B. | CH2═CHC(CH3)2CH(CH3)2 | ||
| C. | (CH3)3CC(CH3)═CHCH3 | D. | (CH3)3CCH(CH3)CH═CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4<HBrO4<HIO4 | B. | 稳定性:HF<HCl<HBr<HI | ||
| C. | 与H2反应由易到难:F2>Cl2>Br2>I2 | D. | 还原性:HF>HCl>HBr>HI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②⑤⑥ | C. | ②⑤⑥ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中X的金属性最强 | |
| B. | 原子半径X>Y,离子半径X+>Y- | |
| C. | 同族元素中Z的氢化物稳定性最高 | |
| D. | 同周期元素中Y的最高价含氧酸的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com