
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.74 | 0.75 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A. | X与Y可以形成阴离子XY32- | |
| B. | Z的氢化物的沸点比T的氢化物的沸点高 | |
| C. | 元素R的氧化物对应的水化物一定为强酸 | |
| D. | 由X形成的化合物XY2和XR4,其中XR4的沸点高 |
分析 短周期元素,元素的最高正化合价与其族序数相等,最低负化合价=族序数-8,同一周期元素,原子半径随着原子序数增大而减小,同一主族元素,原子半径随着原子序数增大而增大,根据图中数据知,X和Q属于第IVA族元素、Z和I属于第VA族元素、Y属于第VIA族元素、R属于第VIIA族元素,R有正化合价所以为Cl元素,X半径小于Q,所以X为C元素、Q为Si元素;X原子半径大于Y,所以Y为O元素;Z的原子半径小于T,所以Z为N元素、T为P元素;再结合题目分析解答.
解答 解:短周期元素,元素的最高正化合价与其族序数相等,最低负化合价=族序数-8,同一周期元素,原子半径随着原子序数增大而减小,同一主族元素,原子半径随着原子序数增大而增大,根据图中数据知,X和Q属于第IVA族元素、Z和I属于第VA族元素、Y属于第VIA族元素、R属于第VIIA族元素,R有正化合价所以为Cl元素,X半径小于Q,所以X为C元素、Q为Si元素;X原子半径大于Y,所以Y为O元素;Z的原子半径小于T,所以Z为N元素、T为P元素;
A.X与Y可以形成阴离子CO32-,故A正确;
B.Z为N元素、T为P元素,N的氢化物中含有氢键、P的氢化物中不含氢键,氢键的存在导致氨气熔沸点高于PH3,故B正确;
C.R为Cl元素,其含氧酸HClO为弱酸,故C错误;
D.由C形成的化合物CO2和CCl4,常温下CO2为气体,CCl4为液体,所以CCl4的沸点高,故D正确;
故选C.
点评 本题考查原子结构和元素性质,明确元素化合价与族序数的关系、物质的结构和性质即可解答,注意Cl元素的含氧酸都具有酸性,但不一定都是强酸,为易错点.


科目:高中化学 来源: 题型:选择题
 若将反应:Zn+H2SO4=ZnSO4+H2↑设计成原电池(如图),则下列说法不正确的是( )
若将反应:Zn+H2SO4=ZnSO4+H2↑设计成原电池(如图),则下列说法不正确的是( )| A. | 该装置实现了化学能转化为电能 | B. | b 极表面发生了还原反应 | ||
| C. | c 溶液可以是ZnSO4 溶液 | D. | 盐桥中的Cl-移向右边烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应停止了 | B. | 正反应速率与逆反应速率均为零 | ||
| C. | 反应物和生成物浓度相等 | D. | 正反应速率与逆反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图①表示25℃时,向盐酸和醋酸混合溶液中滴入氨水过程中电导率(表征溶液导电能力大小的物理量)的变化关系 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)═2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 图③表示10mL 0.01mol•L-1 KMnO4 酸性溶液与过量的0.1mol•L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发展核电、煤中加入生石灰、利用二氧化碳制造全降解塑料都能有效减少环境污染 | |
| B. | 物质变化中炭化、钝化、皂化、酯化、熔化都属于化学变化 | |
| C. | 氢键、分子间作用力、离子键和共价键均为微粒间的相互作用力 | |
| D. | 农业废弃物、城市工业有机废弃物及动物粪便中都蕴藏着丰富的生物质能 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;写出它与原子半径最小的原子形成10电子且为正四面体结构的化合物的电子式
;写出它与原子半径最小的原子形成10电子且为正四面体结构的化合物的电子式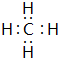 ,用电子式表示⑤和⑧形成化合物的过程
,用电子式表示⑤和⑧形成化合物的过程 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com