
| 现象 | 解释或结论 | |
| A | SO2使酸性高锰酸钾溶液褪色 | SO2表现还原性 |
| B | 浓硝酸在光照条件下变黄 | 浓硝酸不稳定,生成有色物质生成且能溶于浓硝酸 |
| C | 某溶液中加入浓NaOH溶液加热,放出气体能使湿润的红色石蕊试纸变蓝 | 该溶液中一定含有NH4+ |
| D | 将铜片放入浓硫酸中,无明显实验现象 | 铜在冷的浓硫酸中发 生钝化 |
| A、A | B、B | C、C | D、D |


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
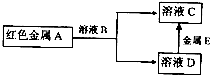
查看答案和解析>>
科目:高中化学 来源: 题型:
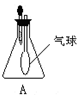 使用装置A进行实验时,将滴管中的液体加入到锥形瓶中,发现气球鼓起来.试推测锥形瓶中的气体和滴管中的物质可能为( )
使用装置A进行实验时,将滴管中的液体加入到锥形瓶中,发现气球鼓起来.试推测锥形瓶中的气体和滴管中的物质可能为( )| A、Cl2和饱和食盐水 |
| B、NO和水 |
| C、O2和水 |
| D、SO2和NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
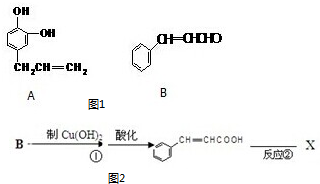
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的基态原子最外层电子排布式为nsnnpn |
| Y | Y是空气中含量最高的元素 |
| Z | Z是地壳中含量最高的金属元素 |
| W | W的单质是常见的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
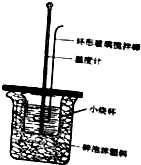 某学习小组制作如图所示简易量热计测定中和反应的反应热,烧杯中,并用温度计测量盐酸的温度;用另一个量筒量取50mL筒中的NaOH溶液一次倒入小烧杯,盖好插有温度计和环形搅拌棒的盖板,匀速搅拌,记录溶液到达的最高温度.
某学习小组制作如图所示简易量热计测定中和反应的反应热,烧杯中,并用温度计测量盐酸的温度;用另一个量筒量取50mL筒中的NaOH溶液一次倒入小烧杯,盖好插有温度计和环形搅拌棒的盖板,匀速搅拌,记录溶液到达的最高温度.查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 温度/K | 反应时间/h | 反应物物质的量配比 | 实验目的 |
| ① | 378 | 3 | 3:1 | 实验②和④探究 实验②和 |
| ② | 378 | 4 | 4:1 | |
| ③ | 378 | 3 | ||
| ④ | 398 | 4 | 4:1 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.4g | B、3.6g |
| C、5.6g | D、6.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 200atm | 600atm | |
| 500℃ | 19.1% | 42.2% |
| A、表中所测数据有明显误差 |
| B、生产条件控制不当 |
| C、氨的分解速率大于预测值 |
| D、合成塔中的反应并未达平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com