
| A. | KNO3 | B. | MgSO4 | C. | CaCl2 | D. | NaCl |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
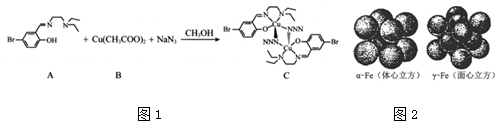
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A12O3属于两性氧化物 | |
| B. | 两步反应中CO均是氧化产物 | |
| C. | Al4C3与盐酸反应可生成烃,该烃为乙烯 | |
| D. | 生成的铝粉不能在空气中冷却 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的浓度一定降低 | B. | 正反应速率一定大于逆应速率 | ||
| C. | 使用了合适的催化剂 | D. | 生成物的百分含量增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com