
分析 (1)加入水稀释,醋酸的电离平衡右移,但是溶液中c(H+)降低;
(2)加入1mol•L-1的醋酸溶液,醋酸浓度增大,平衡正反应方向移动,微粒浓度增大,电离程度减小.
解答 解:(1)醋酸溶液中存在电离:CH3COOH?CH3COO-+H+,加水稀释,醋酸的浓度减小,平衡向右移动,氢离子物质的量增大,但是浓度减小,
故答案为:正反应;增大;减小;
(2)加入1mol•L-1的醋酸溶液,醋酸浓度增大,平衡正反应方向移动,溶液中氢离子物质的量增大,氢离子浓度增大,
故答案为:正反应;增大;增大.
点评 本题考查电离平衡的移动,明确影响平衡移动的因素即可解答,注意利用加水促进电离及同离子效应来分析解答,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | NH3使湿润的红色石蕊试纸变蓝 | |
| B. | 向硅酸钠溶液中滴加适量稀盐酸,有透明的凝胶形成 | |
| C. | 将氯水长期放置,黄绿色消失 | |
| D. | 向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子得电子能力:W<X<Y<Z | B. | 原子最外层电子数::W<X<Y<Z | ||
| C. | 原子半径:W>X>Y>Z | D. | 元素的最高化合价:W<X<Y<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x<y | B. | x=y | C. | x>y | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
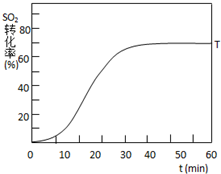 根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料.
根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在下面的装置中,A是Cl2发生装置,C、D为气体的净化装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.试回答:
在下面的装置中,A是Cl2发生装置,C、D为气体的净化装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
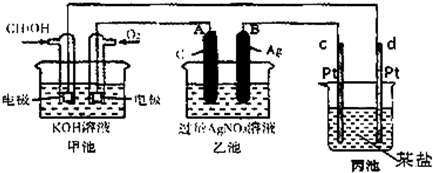
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com