
| 序号 | 操作 | 现象 |
| 实验Ⅰ | 将2mL 1mol/L AgNO3 溶液加入到1mL 1mol/L FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
| 取上层清液,滴加KSCN 溶液 | 溶液变红 |
| 序号 | 操作 | 现象 |
| 实验Ⅲ | 将2mL 2mol/L Fe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
| 实验Ⅳ | 将2mL1mol/L Fe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
| 实验Ⅴ | 将2mL 2mol/L FeCl3溶液加入有银镜的试管中 | 银镜消失 |
分析 (1)①AgNO3 中的银离子与硫酸根离子结合生成硫酸银沉淀;
②AgNO3 溶液加入到FeSO4溶液中有Ag生成,说明银离子被亚铁离子还原,亚铁离子被氧化为铁离子,铁离子遇到KSCN溶液会生成红色溶液;
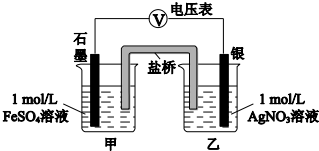
(2)①偏移的方向表明:电子由石墨经导线流向银,银做原电池正极,石墨做原电池负极,甲池溶液中是亚铁离子失电子发生氧化反应生成铁离子,;
②随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,和乙池组成原电池,发现电压表指针的变化依次为,偏移减小→回到零点→逆向偏移,证明银做原电池负极,发生的反应为铁离子氧化为银;
③实验可知银离子具有强氧化性氧化亚铁离子为铁离子;
(3)①酸性溶液中硝酸根离子具有氧化性,也可以溶解银;
②分析选项可知,溶液中存在平衡:Fe3++Ag=Fe2++Ag+,硫酸根离子和氯离子对平衡的影响判断平衡进行的方向解释.
解答 解:(1)①AgNO3 中的银离子与硫酸根离子结合生成硫酸银沉淀,所以生成的白色沉淀为Ag2SO4;
故答案为:Ag2SO4;
②AgNO3 溶液加入到FeSO4溶液中有Ag生成,说明银离子被亚铁离子还原,亚铁离子被氧化为铁离子,铁离子遇到KSCN溶液会生成红色溶液,所以甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag )生成,加入KSCN 溶液后变红;
故答案为:有黑色固体(Ag )生成,加入KSCN 溶液后变红;
(2)①实验过程中电压表指针偏移,偏移的方向表明:电子由石墨经导线流向银,依据原电池原理可知银做原电池正极,石墨做原电池负极,负极是甲池溶液中亚铁离子失电子发生氧化反应生成铁离子,a中甲烧杯里的电极反应式是Fe2+-e-=Fe3+;
故答案为:Fe2+-e-=Fe3+;
②随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,和乙池组成原电池,发现电压表指针的变化依次为,偏移减小→回到零点→逆向偏移,依据电子流向可知乙池中银做原电池负极,发生的反应为铁离子氧化为银生成亚铁离子;
故答案为:负;
③由实验现象得出,Ag+和Fe2+反应生成铁离子和金属银,反应的离子方程式是Fe2++Ag+?Fe3++Ag;
故答案为:Fe2++Ag+?Fe3++Ag;
(3)①将2mL 2mol/L Fe(NO3)3溶液加入有银镜的试管中银镜消失,说明银杯氧化,可能是溶液中铁离子的氧化性,也可能是铁离子水解显酸性的溶液中,硝酸根离子在酸溶液中具有了强氧化性,稀硝酸溶解银,所以实验Ⅲ不能证明Fe3+氧化了Ag,
故答案为:不能;因为Fe(NO3)3溶液呈酸性,酸性条件下NO3-也可能氧化Ag;
②将2mL1mol/L Fe2(SO4)3溶液加入有银镜的试管中银镜减少,未消失说明部分溶解,将2mL 2mol/L FeCl3溶液加入有银镜的试管中银镜消失,说明银溶解完全,依据上述现象可知,溶液中存在平衡:Fe3++Ag?Fe2++Ag+,且AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大,
故答案为:溶液中存在平衡:Fe3++Ag?Fe2++Ag+,且 AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.
点评 本题考查了物质性质的实验设计验证、物质性质的理解、原电池原理分析应用,注意根据实验现象和反应产物分析判断,注意题干信息的理解应用,掌握基础是关键,题目难度较大.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:选择题
| A. | 20gD2O所含电子数为10NA | |
| B. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| C. | 1molNa被氧化成Na2O2,失去电子数目为2NA | |
| D. | 氢气与氯气反应生成标准状况下22.4L氯化氢,断裂化学键总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2、FeCl3 | B. | NaHCO3、Na2CO3 | C. | NaAlO2、AlCl3 | D. | Mg(HCO3)2、MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①②⑤⑥ | C. | ①③④ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com