

分析 (1)实验开始时先检查装置气密性,然后向烧瓶中加入MnO2粉,再向烧瓶中加入浓盐酸,再加热A处酒精灯用产生的氯气排除装置中的空气,最后加热装置D处酒精灯;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(3)浓盐酸易挥发,加热促进盐酸的挥发,制备的氯气中含有氯化氢和水蒸气,依据氯气、氯化氢溶解性选择试剂除去氯化氢,依据浓硫酸具有吸水性选择干燥剂;
(4)根据所给的装置图可知,因为氯化铝易发生水解,故应该防止空气中的水蒸气进入E装置,而G是吸收空气中的CO2,所以可以加入碱石灰来代替F和G的作用.
解答 解:(1)实验开始时先检查装置气密性,然后向烧瓶中加入MnO2粉,再向烧瓶中加入浓盐酸,再加热A处酒精灯用产生的氯气排除装置中的空气,最后加热装置D处酒精灯,所以正确的顺序为:acbd;
故答案为:acbd;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)浓盐酸易挥发,加热促进盐酸的挥发,制备的氯气中含有氯化氢和水蒸气,氯气在饱和食盐水中溶解度很小,氯化氢易溶于水,选择饱和食盐水除去氯化氢,浓硫酸具有吸水性,可以干燥氯气;
故答案为:饱和食盐水、浓硫酸;
(4)因为氯化铝易发生水解,故应该防止空气中的水蒸气进入E装置,而G是吸收反应剩余的氯气,所以可以加入碱石灰或氧化钙来代替F和G的作用,
故答案为:碱石灰或氧化钙;
点评 本题考查了氯气的制备和性质检验,熟悉实验目的和实验原理是解题关键,侧重考查学生的分析能力和实验能力,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 制作印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | Ca(HCO3)2溶液中加足量NaOH溶液:HCO${\;}_{3}^{-}$+Ca2++OH-═CaCO3↓+H2O | |
| C. | 用NaOH溶液吸收Cl2:Cl2+2OH-═Cl-+ClO${\;}_{3}^{-}$+H2O | |
| D. | 明矾常用于净水:Al3++3H2O?Al(OH)3(胶体)+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
| K=6.2×10-10 | K=4.2×10-7 | K=6.61×10-4 |
| A. | 氟化钠溶液中通入C02:2F-+H2O+CO2═2HF+CO32- | |
| B. | NaCN与HCN的混合溶液中:2c(Na+)═c(CN-)+c(HCN) | |
| C. | 25℃时同浓度的NaCN和NaF溶液的pH值前者小于后者 | |
| D. | 三种酸的酸性由强到弱为:HF>H2C03>HCN |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 57.5mL | B. | 55mL | C. | 52.5mL | D. | 50mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12g石墨和C60的混合固体中,含NA个碳原子 | |
| B. | 标准状况下,2.24L水中含有0.1NA个水分子 | |
| C. | 7.8g过氧化钠含有的阴离子数为0.2NA | |
| D. | 0.1mol铁在足量氯气中燃烧,电子转移数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| C. | 欲配制1.00L 1.00mol•L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
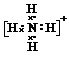 (用元素符号表示)
(用元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8gO2含有4NA个电子 | |
| B. | 1molN2与过量H2反应,转移6NA个电子 | |
| C. | 1L1.0mo1/L的Na2SO4水溶液中含有的氧原子数为4NA | |
| D. | 1L0.1mol/L的氨水中有NA个NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com