
 生物质能是一种洁净、可再生能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.
生物质能是一种洁净、可再生能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.| △ |
| Cu/Ag |
| △ |
| Cu/Ag |
| △ |
| △ |
| △ |
| 1 |
| 8 |


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
| A、分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
| B、能自发进行的化学反应,一定是△H<0、△S>0 |
| C、焰色反应是物质燃烧时火焰呈现的颜色变化,属于化学变化 |
| D、钢铁发生电化学腐蚀时,负极的电极反应式为 Fe-3e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氨在国民经济中占有重要地位.
氨在国民经济中占有重要地位.查看答案和解析>>
科目:高中化学 来源: 题型:
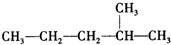 :
: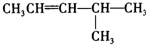 :
: :
: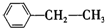 :
:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
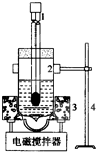
查看答案和解析>>
科目:高中化学 来源: 题型:
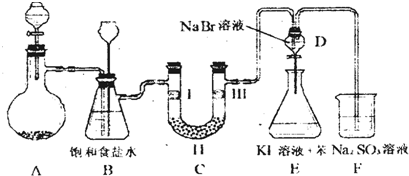
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
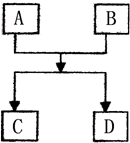 已知A、B、C、D的组成元素都属于短周期,其中A、D为单质,B、C为化合物,它们之间的简单转化关系如图.请按要求完成此框图对应的转化关系.
已知A、B、C、D的组成元素都属于短周期,其中A、D为单质,B、C为化合物,它们之间的简单转化关系如图.请按要求完成此框图对应的转化关系.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com