
|
向一容积为1 L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)
| |
| [ ] | |
A. |
用X表示0~10 min内该反应的平均速率为0.025 mol/(L·min) |
B. |
根据上图可求得方程式中a∶b=2∶1 |
C. |
0~10 min容器内气体的压强逐渐增小 |
D. |
第13 min时曲线变化的原因可能是增加了Z的量 |
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源:陕西省宝鸡中学2011-2012学年高二下学期期中考试化学试题 题型:022
向一容积为1 L的密闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s)![]() 2Z(g);ΔH<0.下图是容器中X、Z的物质的量浓度随时间变化的曲线.
2Z(g);ΔH<0.下图是容器中X、Z的物质的量浓度随时间变化的曲线.
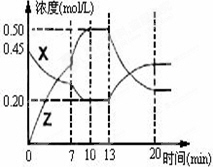
(1)0~10 min容器内气体的压强逐渐________.(填“变大”、“变小”或“无法确定”)
(2)推测在第7 min时曲线变化的原因可能是________第13 min时曲线变化的原因可能是________(填序号)
①增加Z的量
②增加X的量
③升温
④降温
⑤使用催化剂
查看答案和解析>>
科目:高中化学 来源:福建省永安一中2011-2012学年高二上学期期中考试化学试题 题型:022
Ⅰ.在1 L容器中通入CO2、H2各2 mol,在一定条件下发生反应:CO2+H2![]() CO+H2O,回答下列问题:
CO+H2O,回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的转化率为50%.求该条件下平衡常数K1=________.
(2)在(1)的基础上,把体系温度降至800℃.已知该条件下的平衡常数K2=0.81,可以推知该反应的正反应为________反应(填“吸热”、“放热”).
(3)在(1)的基础上,压缩容器体积之0.5 L.该条件下的平衡常数为K3.则K3________K1
(4)T℃时,某时刻测得体系中各物质的量如下:n(CO2)=1.2 mol,n(H2)=1.5 mol,
n(CO)=0.9 mol,n(H2O)=0.9 mol,则此时该反应________进行.(填“向正反应方向”“向逆反应方向”或“处于平衡状态”).
Ⅱ.向一容积为1 L的密闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y( s)![]() 2Z(g);ΔH<0.下图是容器中X、Z的物质的量浓度随时间变化的曲线.
2Z(g);ΔH<0.下图是容器中X、Z的物质的量浓度随时间变化的曲线.
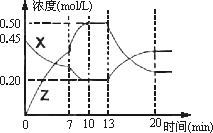
(1)0~10 min容器内气体的压强逐渐________.(填“变大”、“变小”或“无法确定”)
(2)推测在第7 min时曲线变化的原因可能是________第13 min时曲线变化的原因可能是________(填序号)
①增加Z的量
②增加X的量
③升温
④降温
⑤使用催化剂
查看答案和解析>>
科目:高中化学 来源:河北衡水中学2008-2009学年度高三上学期期中考试(化学) 题型:021
|
向一容积为1 L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)
| |
A. |
用X表示0~10 min内该反应的平均速率为0.025 mol/(L·min) |
B. |
根据上图可求得方程式中a∶b=2∶1 |
C. |
0~10 min容器内气体的压强逐渐增大 |
D. |
第13 min时曲线变化的原因可能是增加了Z的量 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省龙岩市高三上学期期末考试化学试卷(解析版) 题型:填空题
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H=-76.0 kJ·mol一1
①上述反应中每生成1 mol Fe3O4,转移电子的物质的量为_______mol。
②已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4 kJ·mol一1,则反应:3FeO(s)+ H2O(g)= Fe3O4(s)+ H2(g)的△H=__________。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4 H2 (g)  C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2
0.2 mol·L一1,H2
0.8 mol·L一1,CH40.8
mol·L一1,H2O1.6
mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
C H4 (g)+2 H2O(g),向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2
0.2 mol·L一1,H2
0.8 mol·L一1,CH40.8
mol·L一1,H2O1.6
mol·L一1。则CO2的平衡转化率为________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_____(填“>’’或“<”)O。
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如
图所示:

①上述生产过程的能量转化方式是____________________。
②上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com