
| 共价键 | H-H | F-F | H-F | H-Cl | H-I |
| E(kJ•mol-1) | 436 | 157 | 568 | 432 | 298 |
| A. | 432kJ•mol-1>E(H-Br)>298kJ•mol-1 | B. | H2(g)+F2(g)=2HF(g)△H=25kJ•mol-1 | ||
| C. | 表中最稳定的共价键是H-F | D. | H2(g)→2H(g)△H=+436kJ•mol-1 |
分析 A、依据溴原子半径大于氯原子小于碘原子,半径越大键能越小分析推断;
B、键能越大形成的化学键越稳定;
C、氢气变化为氢原子吸热等于氢气中断裂化学键需要的能量;
D、依据键能计算反应焓变=反应物键能总和-生成物键能总和计算判断.
解答 解:A、依据溴原子半径大于氯原子小于碘原子,半径越大键能越小分析,所以结合图表中数据可知432 kJ•mol-1>E(H-Br)>298 kJ•mol-1,故A正确;
B、依据键能计算反应焓变=反应物键能总和-生成物键能总和计算判断,△H=436KJ/mol+157KJ/mol-2×568KJ/mol=-543KJ/mol,H2(g)+F2(g)=2HF(g)?△H=-543 kJ•mol-1,故B错误;
C、键能越大形成的化学键越稳定,表中键能最大的是H-F,最稳定的共价键是H-F键,故C正确;
D、氢气变化为氢原子吸热等于氢气中断裂化学键需要的能量,H2(g)→2H (g)?△H=+436 kJ•mol-1 ,故D正确;
故选B.
点评 本题考查了化学反应能量变化和键能的关系分析判断,焓变计算方法是解题关键,题目难度中等.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| 弱酸 | HCOOH | HCN | H2S |
| 电离平衡常数(25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
| A. | 恰好中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者 | |
| B. | HCOO-、CN-、HS-在溶液中不可以大量共存 | |
| C. | NaHS溶液中加入适量KOH后:c(Na+)═c(H2S)+c(HS-)+2C(S2-) | |
| D. | 等体积、等浓度的HCOONa和NaCN两溶液中所含离子总数目HCOONa大于NaCN |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | ||
| T |
| A. | 元素X、W、Z在自然界中均可以游离态存在 | |
| B. | 元素X、Y、W的原子半径依次递增 | |
| C. | 实验室储存T的单质时,应在其表面覆盖少量的水 | |
| D. | 元素Z的氧化物是制作计算机芯片的材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
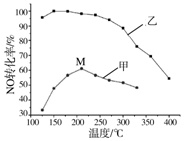 氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0
氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | NH4HCO3溶液和足量氢氧化钠溶液反应:NH4++OH-═NH3•H2O | |
| C. | 向FeBr2溶液中通入少量氯气:Fe2++Cl2═Fe3++2Cl- | |
| D. | 氯气与Na2SO3溶液反应:Cl2+SO32-+H2O═SO42-+2Cl-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有卤代烃都难溶于水,且都是密度比水大的液体 | |
| B. | 所有卤代烃都是通过取代反应制得 | |
| C. | 卤代烃可用作制冷剂、灭火剂 | |
| D. | 卤代烃都是良好的有机溶剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com