
| A. | PH=4.3的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | |
| B. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| C. | 若Ksp(AgCl)>Ksp(Ag2CrO4),则AgCl 的溶解度大于Ag2CrO4的溶解度 | |
| D. | 向醋酸溶液中加少量水稀释后,溶液中 c(CH3COOH)增大 |
分析 A.根据电荷守恒判断;
B.CH3COONH4促进水的电离;
C.化学式构成形式不同,不能用溶度积比较溶解度大小;
D.向醋酸溶液中加少量水稀释,促进醋酸的电离,且溶液体积增大.
解答 解:A.CH3COONa与CH3COOH的混合溶液的pH=4.3<7,则:c(OH?)<c(H+),据电荷守恒c(CH3COO?)+c(OH?)=c(H+)+c(Na+)可得c(Na+)<c(CH3COO-),故A正确;
B.CH3COONH4为弱酸弱碱盐,促进水的电离,故B错误;
C.化学式构成形式不同,不能用溶度积比较溶解度大小,不能比较溶解度大小,故C错误;
D.向醋酸溶液中加少量水稀释,促进醋酸的电离,且溶液体积增大,则 c(CH3COOH)减小,故D错误.
故选A.
点评 本题考查弱电解质的电离难溶电解质的溶解平衡,为高频考点,侧重分析与应用能力的考查,注意把握电荷守恒的运用以及溶度积的意义,题目难度不大.


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 纽扣式银锌电池的构造如图所示,电池的总反应为:Zn+Ag2O+H2O=Zn(OH)2+2Ag,下列说法不正确的是( )
纽扣式银锌电池的构造如图所示,电池的总反应为:Zn+Ag2O+H2O=Zn(OH)2+2Ag,下列说法不正确的是( )| A. | Zn作正极 | B. | 电子经外电路流向Ag2O极 | ||
| C. | OH-向Zn极移动 | D. | 正极反应:Ag2O+H2O+2e-=2Ag+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焚烧废旧塑料以防止“白色污染” | |
| B. | 大量CO2排放可导致酸雨的形成 | |
| C. | 积极开发风力、太阳能发电,改善能源结构 | |
| D. | 玛瑙、水晶、钻石、红宝石等装饰品的主要成分都是硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 利用铅蓄电池对如图装置进行供电,能模拟植物光合作用,将简单无机物转化为O2和C3H8O,下列说法不正确的是( )
利用铅蓄电池对如图装置进行供电,能模拟植物光合作用,将简单无机物转化为O2和C3H8O,下列说法不正确的是( )| A. | 该装置实现了将太阳能、电能转化为化学能 | |
| B. | b极上每生成0.1molO2,铅蓄电池的负极增重19.2g | |
| C. | a极上每生成0.1molC3H8O,有1.8mol电子发生转移 | |
| D. | 质子交换膜的作用是传导电子、平衡电荷,沟通回路 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| B. | 相同浓度的CH3COONa和NaClO的混合溶液中,c(CH3COOH)+c(HClO)═c(OH-)-c(H+) | |
| C. | 25℃时,0.10mol•L-1Na2CO3溶液通入CO2至溶液的pH=7时,溶液中:c(Na+)═c(CO32-)+c (HCO3-)+c(H2CO3) | |
| D. | 向0.1mol•L-1CH3COONa溶液中加入少量水,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COO)•c(O{H}^{-})}$ 增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 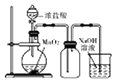 实验室制取Cl2 | B. | 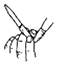 检查碱式滴定管是否漏液 | ||
| C. | 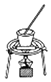 从食盐水中提取NaCl | D. | 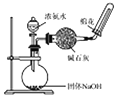 制备收集干燥的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去).下列说法错误的是( )
甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去).下列说法错误的是( )| A. | 若戊为一种强碱且焰色反应为黄色,则反应①②可能都属于氧化还原反应 | |
| B. | 常温下,若丙为无色气体,戊为红棕色气体,则甲、乙是铜和稀硝酸 | |
| C. | 若甲为硫磺燃烧产物,丁为水,则戊可用于干燥甲 | |
| D. | 若甲为浓盐酸,乙为MnO2,则戊可能使品红褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com