

分析 根据题目给出的信息可知:随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2,因此化学小组所制得的气体中混有的主要杂质气体可能是氢气;A是制取气体的装置,B是吸收二氧化硫的装置,可以用氢氧化钠等碱液吸收;C是检验二氧化硫是否除尽的装置,D是浓硫酸,吸水干燥作用;E是用还原性气体还原氧化铜的装置,F中盛放的是无水硫酸铜,检验是否有水生成;G是防止空气中H2O进入干燥管而影响杂质气体的检验.
(1)该仪器名称是分液漏斗;C(H2SO4)=$\frac{1000ρw}{M}$;
(2)锌和稀硫酸反应生成硫酸锌和氢气;
(3)①二氧化硫属于酸性氧化物,能被碱液吸收;具有还原性,能被强氧化性溶液吸收;
②氢气具有还原性,能还原氧化铜,且生成水,水能使无水硫酸铜变蓝色.
解答 解:(1)该仪器名称是分液漏斗,C(H2SO4)=$\frac{1000ρw}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4 mol/L,
故答案为:分液漏斗;18.4 mol/L;
(2)锌和稀硫酸反应生成硫酸锌和氢气,离子方程式为Zn+2H+═Zn2++H2↑,故答案为:Zn+2H+═Zn2++H2↑;
(3)①二氧化硫属于酸性氧化物,能被碱液吸收;具有还原性,能被强氧化性溶液吸收,氢氧化钠溶液呈碱性,高锰酸钾溶液具有强氧化性,所以可以用氢氧化钠溶液和高锰酸钾溶液吸收二氧化硫,故选B,
故答案为:B;
②氢气具有还原性,能将黑色的CuO还原为红色的Cu,且生成水,水能使无水硫酸铜变蓝色,所以如果有氢气,看到的现象是:装置E中黑色粉末变红色,F中无水硫酸铜变蓝色,
故答案为:装置E中黑色粉末变红色,F中无水硫酸铜变蓝色.
点评 本题考查了探究实验,明确实验原理是解本题关键,根据物质的性质来分析解答,注意二氧化硫的漂白性,为常考查点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 小于200mL | B. | 200mL | C. | 大于200mL | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
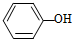
 、CH 3COOH、HCl的排列中,
、CH 3COOH、HCl的排列中, 应填入的物质是( )
应填入的物质是( )| A. | H2SO4 | B. | CH3CH2OH | C. | H2CO3 | D. | CH3COOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入Cu(OH)2浊液之前,未用NaOH溶液中和硫酸 | |
| B. | 制Cu(OH)2时,硫酸铜溶液太稀,NaOH过量了 | |
| C. | 加热时间不充分,淀粉没有充分水解 | |
| D. | 所用淀粉浓度不够 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
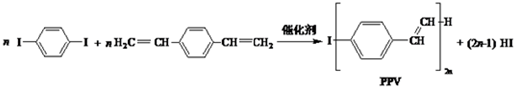
| A. | 合成PPV的反应为缩聚反应 | |
| B. | PPV与聚苯乙烯具有相同的重复结构单元 | |
| C. | 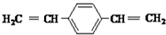 和苯乙烯互为同系物 和苯乙烯互为同系物 | |
| D. | 通过红外光谱测定PPV的平均相对分子质量,可得其聚合度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
| B | 乙烷(乙烯) | 氢气 | 加热 |
| C | 溴(水) | 乙醇 | 蒸馏 |
| D | 乙醇(水) | 新制生石灰 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘 | |
| B. | 当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据 | |
| C. | 蒸馏操作时,温度计水银球的位置应在蒸馏烧瓶的支管口处 | |
| D. | 提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、HSO3-、Cl- | B. | H+、Al3+、Fe3+、I- | ||
| C. | NH4+、K+、Cl-、NO3- | D. | Na+、Ba2+、AlO2-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③④⑤ | C. | ②③④ | D. | ②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com