
汽车尾气中的NOx是大气污染物之一,科学家们在尝试用更科学的方法将NOx转化成无毒物质,从而减少汽车尾气污染。
(1)压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2。
①CH4(g)+4NO2(g) 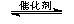 4NO(g)+CO2(g)+2H2O(g)?? △H1<0
4NO(g)+CO2(g)+2H2O(g)?? △H1<0
②CH4(g)+4NO(g) 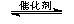 2N2(g)+CO2(g)+2H2O(g)???? △H2<0
2N2(g)+CO2(g)+2H2O(g)???? △H2<0
③CH4(g) +2NO2(g) 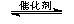 N2(g) +CO2(g) +2H2O(g)? △H3=????????? 。(用△H1和△H2表示)
N2(g) +CO2(g) +2H2O(g)? △H3=????????? 。(用△H1和△H2表示)
(2)在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应③,在不同温度、不同投料比时,NO2的平衡转化率见下表:
投料比[n(NO2) / n(CH4)] | 400 K | 500 K | 600 K |
1 | 60% | 43% | 28% |
2 | 45% | 33% | 20% |
①写出该反应平衡常数的表达式K=????????? 。
②若温度不变,提高[n(NO2) / n(CH4)]投料比,则K将????????? 。(填“增大”、“减小”或“不变”。)
③400 K时,将投料比为1的NO2和CH4的混合气体共0.04 mol,充入一装有催化剂的容器中,充分反应后,平衡时NO2的体积分数???????? 。
(3)连续自动监测氮氧化物(NOx)的仪器动态库仑仪的工作原理示意图如图1
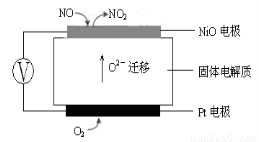

图1???????????????????????????????????? 图2
①NiO电极上NO发生的电极反应式:???????????????????????????????? 。
②收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V(NO)︰V(NO2)=???
(4)在容积相同的两个密闭容器内 (装有等量的某种催化剂) 先各通入等量的CH4,然后再分别充入等量的NO和NO2。在不同温度下,同时分别发生②③两个反应:并在t秒时测定其中NOx转化率,绘得图象如图2所示:
①从图中可以得出的结论是
结论一:相同温度下NO转化效率比NO2的低
结论二:在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小
结论二的原因是????????????????????????????????????????????????????
②在上述NO2和CH4反应中,提高NO2转化率的措施有_________。(填编号)
A.改用高效催化剂???? B.降低温度???? C.分离出H2O(g)?????? D.增大压强
E.增加原催化剂的表面积?? F.减小投料比[n(NO2) / n(CH4)]
(1)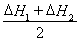 ?? (1分)
?? (1分)
(2)①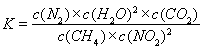 ?? (1分)???? 不变?? (2分)
?? (1分)???? 不变?? (2分)
② 17.4%??????? (2分)
(3)① NO + O2 --2e- = NO2? (2分)
② 1 : 1?????????????????? (2分)
(4)① 原因是:在250℃-450℃时,反应未达到平衡,反应还在正向进行。? (1分)
450℃-600℃时,反应已达平衡,所以,温度升高平衡逆向移动,NOx转化率随温度升高而减小。(其他合理答案也给分)?? (1分)
② BCF???????? (2分)
【解析】
试题分析:(1)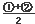 即为目标方程式③,所以,
即为目标方程式③,所以,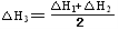
(2)① 该反应的平衡常数的表达式 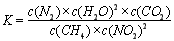
② 平衡常数K不受浓度和压强的影响,只受温度的影响,温度不变K不变。
③ 400 K时,将投料比为1的NO2和CH4的混合气体共0.04 mol,充入一装有催化剂的容器中,充分反应后,平衡时NO2的体积分数为:
???????? CH4(g)? +? 2NO2(g)  N2(g) + CO2(g) + 2H2O(g)
N2(g) + CO2(g) + 2H2O(g)
n始???? 0.02??????? 0.02????????? 0??????? 0????????? 0
n转??? 0.006? 0.02×0.6=0.012?? 0.006??? 0.006????? 0.012
n平??? 0.014?????? 0.008??????? 0.006??? 0.006????? 0.012
0.014 + 0.008 + 0.006 + 0.006 + 0.012 = 0.046
平衡时NO2的体积分数=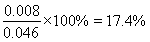
(3)连续自动监测氮氧化物(NOx)的仪器动态库仑仪实际上就是应用原电池原理,从图1可知Pt电极(通入O2的一极)为电池的正极,NiO电极(通入NO的一极)为电池的负极,O2 –可以通过固体电解质移向负极。所以,
① NiO电极上NO发生的电极反应式:NO + O2 --2e- = NO2 。
② 1×104L(标准状况下)尾气中含NOx的体积为:1×104L×1.12% = 112L,
NOx的物质的量为: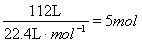 。
。
设NO和NO2的物质的量分别为x、y mol,根据反应化学方程式①和②:
① CH4(g) + 4NO2(g) 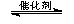 4NO(g) + CO2(g)+2H2O(g)????
4NO(g) + CO2(g)+2H2O(g)????
?? 16g??????? 4??????????????? 4
?? m 1???????????? y??????????????? y????? m 1 = 4y
② CH4(g) + 4NO(g)  2N2(g) + CO2(g)+2H2O(g)??
2N2(g) + CO2(g)+2H2O(g)??
16g??????? 4????????
m 2 ????? (x+y)???????????????????? m 2 = 4(x+y)
则: x+y = 5;4(x+y)+ 4y = 30
解得:x =2.5 mol = 2.5 mol
所以,尾气中V(NO)︰V(NO2) = 1 ︰ 1 。
(4)①从图2 变化曲线分析,结论二的原因是:在250℃-450℃时,反应未达到平衡,反应还在正向进行;故NOx转化率随温度升高而增大;在在450℃-600℃时反应已达到平衡状态,因为该反应是放热反应,此时温度升高平衡逆向移动,故 NOx转化率随温度升高而减小。
② 由上述NO2和CH4反应的化学方程式的特点分析可知: 该反应是放热反应;该反应是扩大气体体积的反应。所以要提高NO2转化率,可降低温度,降低温度能使平衡正向移动,从而提高NO2转化率;分离出H2O,相当于减小生成物的浓度,使平衡正向移动,从而提高NO2转化率;减小投料比[n(NO2) / n(CH4)],相当于增加反应物CH4的浓度,使平衡正向移动,从而增大NO2转化率。而使用催化剂只能改变反应速率,不影响平衡移动,故NO2转化率不会变化。增大压强,平衡逆移,NO2转化率会减小。因此选B C F。
考点:考查化学反应基本理论,涉及氧化还原反应、化学反应速率与化学平衡、化学反应与能量变化、电化学等


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:江苏省梅村高级中学2012届高三12月双周练化学试题 题型:022
某混合动力车,可以用电动机、内燃机或二者结合推动车轮.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态.
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1 mol水蒸气放热569.1 kJ.则该反应的热化学方程式为________.
(2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液.镍氢电池充放电原理示意如图,其总反应式是:
 H2+2NiOOH
H2+2NiOOH根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH将________(填“增大”、“不变”或“减小”),该电极的电极反应式为________.
(3)汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度:CO(g)+1/2O2(g)![]() CO2(g).
CO2(g).
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示.请填写表中的空格.

②相同温度下,某汽车尾气中CO、CO2的浓度分别为1.0×10-5 mol·L-1和1.0×10-4mol·L-1.若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×10-4 mol·L-1,则最终尾气中CO的浓度为________mol·L-1.
(4)汽车尾气中的NOx是另一种大气污染物,可用NH3在催化剂存在下净化,写出该反应的化学方程式________.当参加反应的NH3在标准状况下体积为a L时,还原产物的质量为________g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是( )
A.汽车尾气中的NOx是造成光化学烟雾的唯一因素
B.空气中SO2、NOx等是形成酸雨的重要原因
C.冬天撒盐融雪能造成土壤和水污染
D.河流入海口处形成的三角洲是海水使河水泥沙胶体凝聚的结果
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com