
【题目】研究和深度开发CO、CO2的应用具有重要的社会意义.回答下列问题:
I、CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1= a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2 (g) △ H2= b kJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g) 的△H= ______________________________kJ/mol
II、某温度下,在容积为2 L的密闭容器甲中投入8molCO2(g)、16molH2(g)发生反应:
CO2 (g)+H2(g) ![]() CO(g)+H2O(g) 甲容器15 min后达到平衡,此时CO2的转化率为75%。则015 min内用二氧化碳表示平均反应速率v(CO2)= _________________,计算此条件下该反应的平衡常数K= _________________。
CO(g)+H2O(g) 甲容器15 min后达到平衡,此时CO2的转化率为75%。则015 min内用二氧化碳表示平均反应速率v(CO2)= _________________,计算此条件下该反应的平衡常数K= _________________。
III、捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。目前NH3和(NH4)2CO3等物质已经被用作工业捕碳剂。
(1)下列物质中不可能作为CO2捕获剂的是___________。
A.Na2CO3 B.NaOH C.CH3CH2OH D.NH4Cl
(2)用(NH4)2CO3捕碳的反应:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
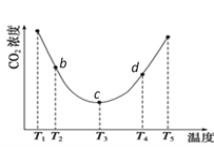
①c点的逆反应速率和d点的正反应速率的大小关系为V逆c _____V正d (填“>”、“=”或“<”)
②b、c、d三点的平衡常数K b 、K c、 Kd 从大到小的顺序为 ________________________________。
【答案】(2a+b)/3 0.2mol/(L·min) 1.8 C D < K b>K c >Kd
【解析】
I、CO可用于高炉炼铁,已知:①Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1= a kJ/mol,②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=bkJ/mol,则1/3[①![]() +②]得反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g)的△H= (2a+b)/3kJ/mol;答案:(2a+b)/3;
+②]得反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g)的△H= (2a+b)/3kJ/mol;答案:(2a+b)/3;
II、①设反应的CO2为Xmol,
CO2 (g)+H2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)
起始量(mol/L)4 8 0 0
变化量(mol/L)X X X X
平衡量(mol/L)4-X 8-X X X
由15min后达到平衡时CO2的转化率为75%,所以![]() =75%,所以X=3mol/L, 015 min CO2平均反应速率为v(CO2)= 3mol/L
=75%,所以X=3mol/L, 015 min CO2平均反应速率为v(CO2)= 3mol/L![]() 15min= 0.2mol/(L·min);
15min= 0.2mol/(L·min);
②上述条件下反应的平衡常数K=32![]() (1
(1![]() 5)=1.8;
5)=1.8;
答案:0.2mol/(L·min) ;1.8。
III、根据捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。A.Na2CO3、B.NaOH均能和CO2反应,可以用作工业捕碳剂,而C.CH3CH2OH、D.NH4Cl均不能和CO2反应,故不可以用作工业捕碳剂。所以答案:C、D;
(2)由图像可知,c点曲线出现折点,c点前半段,由于为温度低,化学反应速率慢,在此时间没有平衡,因此一直在正向移动,CO2的浓度降低;c点后半段,由于温度高,反应在此时间内达到平衡,因此后判断变化趋势,体现了温度对平衡移动的影响,温度升高,CO2的浓度升高,逆向移动,逆反应为吸热反应,则正反应为放热反应。①c点和d点,均处于平衡状态,正反应速率等于逆反应,温度越高,反应速率越大,则c点处的正逆反应速率小于d点处的正逆反应速率,则有V逆c <V正d;
②根据图像该化学反应随温度的升高,平衡逆向移动,所以该反应是放热反应,b、c、d三点温度逐渐升高,所以b、c、d三点的平衡常数K b >K c>Kd ,所以答案:K b>K c >Kd。


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】对![]() 的性质进行探究,设计了以下实验
的性质进行探究,设计了以下实验

已知:![]() 、
、![]() 、
、![]() 等称之为拟卤素,它们的化学性质均与卤素单质相似。下列说法正确的是
等称之为拟卤素,它们的化学性质均与卤素单质相似。下列说法正确的是
A.溶液颜色变红时发生反应的离子方程式是:![]()
B.红色溶液褪色表现了![]() 的漂白性
的漂白性
C.氧化性:![]()
D.无色溶液Ⅱ中滴入适量的![]() 溶液,溶液又变成红色
溶液,溶液又变成红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍、钴、钛、铜等元素常用作制备锂离子电池的正极材料或高效催化剂。NA表示阿伏加德罗常数,请填写下列空白。
(1)基态Co原子的电子排布式为___。
(2)镍与CO生成的配合物Ni(CO)4中,易提供孤电子对的成键原子是___(填元素名称);1 molNi(CO)4中含有的σ键数目为__;写出与CO互为等电子体的一种阴离子的化学式_____。
(3)Ti(BH4)2是一种储氢材料。BH4-的空间构型是____,B原子的杂化方式__。与钛同周期的第ⅡB族和ⅢA族两种元素中第一电离能较大的是___(写元素符号),原因是____。
(4)CuFeS2的晶胞如图所示,晶胞参数分别为anm、bnm、cnm;CuFeS2的晶胞中每个Cu原子与___个S原子相连,晶体密度ρ=___g·cm3(列出计算表达式)。

以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子2和3的坐标分别为(0,1,![]() )、(
)、(![]() ,
,![]() ,0),则原子1的坐标为___。
,0),则原子1的坐标为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锌碘液流电池具有能量密度高、循环寿命长等优势,其工作原理如图所示。下列说法错误的是

A. 放电时电流从石墨电极流向锌电极
B. 充电时阳极反应式为:3I--2e-=I3-
C. 若将阳离子交换膜换成阴离子交换膜,放电时正负极也随之改变
D. 放电时左侧电解质储罐中的离子总浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、容积为2L的密闭容器中通入1 mol X和2 mol Y,发生反应:X(g)+2Y(g)![]() M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是
M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是
A. 0~5 min,Y的平均反应速率为0.08 mol·L-1·min-1
B. 当容器中混合气体密度不变时达到平衡状态
C. 平衡后升高温度,X的反应速率降低
D. 到达平衡状态时,反应放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。
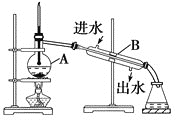
(1)指出图中两处明显的错误
①______________________________________________,
②_____________________________________________。
(2)A仪器的名称是_______________,B仪器的名称是_______________。
(3)实验时A中除加入少量自来水外,还需加入少量碎瓷片,其作用是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.利用下图装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ/mol):_______________________________________________________________
(2)学生甲用稀硫酸与稀烧碱溶液测定中和热装置如图。

①实验时所需要的玻璃仪器除烧杯、量筒外还需要:_________。
②该装置中有一处错误是:______________________,
(3)用相同浓度和体积的氨水(NH3· H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会________(填“偏大”、“偏小”或“无影响”)。
Ⅱ.(1)已知充分燃烧一定质量的丁烷(C4H10)气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则表示丁烷燃烧热的热化学方程式为______________________
(2)已知下列热化学方程式:
C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJmol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJmol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599kJmol-1
请写出C(s,石墨)和H2(g)生成1mol C2H2(g)的热化学方程式____________________
(3)已知几种共价键的键能数据如下表:
共价键 | N≡N | H—H | N—H |
键能 (kJ/mol) | 946 | 436 | 390.8 |
写出合成氨反应的热化学方程式: ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用图装置制取氯气,并进行相关性质的实验。
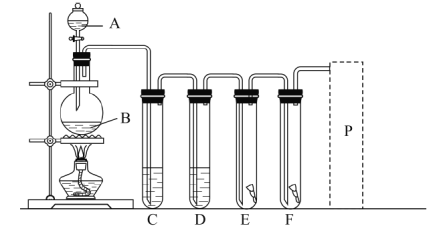
(1)A、B两仪器的名称:A________、B________。
(2)写出实验室用此装置制取氯气的化学方程式________。
(3)为了得到纯净干燥的氯气,写出装置C、D中应该加入的药品的名称:C____、D_________。
(4)E中放入红色干布条,F中放入红色湿布条。可观察到的现象是________,写出发生反应的化学方程式________。
(5)P处为尾气处理装置,画出装置图,标出所用的药品。________

(6)NaClO是“84”消毒液的有效成分。请回答下列问题。
①NaClO中Cl元素的化合价是______。
②用氢氧化钠溶液和氯气反应制备“84”消毒液,反应的离子方程式是_______。
③若将“84”消毒液与洁厕灵(主要成分是盐酸)混合使用,则会产生黄绿色的有毒气体,其反应的离子方程式是_________。
(7)FeCl3在现代工业中应用广泛,某化学研究性学习小组模拟工业生产流程制备无水FeCl3。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华,无水CaCl2是常用的干燥剂。他们设计了制备无水FeCl3的实验方案,装置示意如图(加热、加持及尾气处理装置略去)及操作步骤如下:
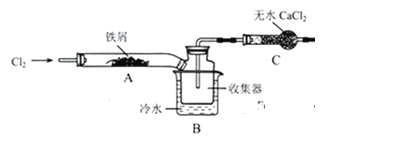
①检查装置气密性
②通入干燥的氯气,赶尽装置内的空气
③用酒精灯在铁屑下方加热至反应完成
④……
⑤体系冷却后,停止通入氯气,并用干燥的的氮气赶尽氯气,将收集器密封。
请回答下列问题:
①装置A中发生反应的化学方程式_____________。
②步骤③加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A的右端。要使沉积的FeCl3进入收集器,第④步操作是________。
③操作步骤中,为防止潮解所采取的措施有(填步骤序号)________。
④装置B中的冷却水作用为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com