
下列各组原子中,彼此化学性质一定相似的是
A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.2p轨道上有三个未成对的电子的X原子与3p轨道上有三个未成对的电子的Y原子
D.最外层都只有一个电子的X、Y原子
科目:高中化学 来源:2016届安徽省等六校教研会高三第一次联考化学试卷(解析版) 题型:选择题
已知:A(g)+ 3B(g) M(g)+ N(g); ΔH=-49.0 kJ•mol-1。一定条件下,向体积为2 L的密闭容器中充入2 mol A和6molB,测得A和M的浓度随时间变化曲线如图所示。下列叙述中,正确的是
M(g)+ N(g); ΔH=-49.0 kJ•mol-1。一定条件下,向体积为2 L的密闭容器中充入2 mol A和6molB,测得A和M的浓度随时间变化曲线如图所示。下列叙述中,正确的是
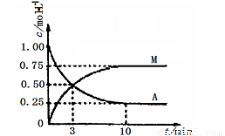
A、充分反应后该反应放出98 kJ的热量
B、10min后,升高温度能使n(M)/n(A)增大
C、3min时B的生成速率是M生成速率的3倍
D、反应到达平衡时刻B的转化率为75%
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古包头九中高一上10月月考化学试卷(解析版) 题型:选择题
取m g相对原子质量为M的某金属与足量稀硫酸反应,在标准状况下产生a L氢气,该反应生成的硫酸盐中金属的化合价为
A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东寿光中学高一上10月月考化学试卷(解析版) 题型:实验题
(21分)氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请你根据所学知识回答下列问题:
Ⅰ.把氯气通入紫色石蕊溶液中,可以观察到的现象是:
请你解释其中的原因_________________________________
Ⅱ.某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液。
(1)其反应原理为:(用化学方程式表示)__________________________
(2)实验室配制好4.0 mol·L-1的NaOH溶液,这种溶液___________L才能与2.24 L氯气(标准状况)恰好完全反应。
(3)配制500 mL 4.0 mol·L-1 NaOH溶液的实验步骤:
a.计算需要氢氧化钠固体的质量。
b.称量氢氧化钠固体。
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶。
d.用适量蒸馏水溶解称量好的氢氧化钠固体,冷却。
e.盖好瓶塞,反复上下颠倒,摇匀。
f.继续向容量瓶中加蒸馏水至刻度线下1 cm~2 cm时,改用胶头滴管加蒸馏水至凹液面与刻度线相切。
①所需称量的氢氧化钠固体的质量是__________________。
②上述步骤的正确操作顺序是________________________。
③上述实验需要的仪器有____________________________。
④某同学观察液面的情况如图所示,对所配溶液的物质的量浓度有何影响? _______________(填“偏高”、“偏低”或“无影响”);
⑤在配制溶液的过程中,下列操作能造成结果偏低的是___________。
A.容量瓶不干燥,含有少量蒸馏水
B.溶解所用烧杯未洗涤
C.NaOH溶解后,未冷却即进行实验
D.定容后摇匀,发现液面低于刻度线
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期四调考试化学试卷(解析版) 题型:选择题
X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的离子就是一个质子;Y原子的最外层电子数是内层电子数的2倍;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;M是地壳中含量最高的金属元素。下列说法正确的是
A.五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X
B.X、Z两元素能形成原子个数比(X︰Z)为3︰1和4︰2的化合物
C.化合物YW2、ZW2都是酸性氧化物
D.用M单质作阳极,石墨作阴极电解NaHCO3溶液,电解一段时间后,在阴极区会出现白色沉淀
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上10月月考化学试卷(解析版) 题型:填空题
(6分)现有①NaCl晶体 ②液态SO3 ③液态的醋酸 ④铝 ⑤BaSO4固体 ⑥纯蔗糖(C12H22O11)⑦酒精(C2H5OH) ⑧熔化的KNO3,请回答下列问题(填序号)
(1)属于电解质的是 。
(2)属于非电解质的是 。
(3)能导电的是 。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上学期第一次模拟化学试卷(解析版) 题型:选择题
研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法不正确的是

A.OC段离子反应方程式为H++OH-===H2O
B.溶液中n(NH4+)=0.012 mol
C.溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+
D.欲测定F点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南外国语学校高三上学期期中测试化学试卷(解析版) 题型:选择题
将浓度为0.1mol/LHF溶液加水不断稀释,下列各量始终保持增大的是
A.c(H+) B.Ka(HF) C. D.
D.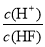
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔高二上10月月考化学试卷(解析版) 题型:填空题
(12分)
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ
某科学实验将6mol CO2和8mol H2充入一容积为2L的密闭容器中,测得H2的物质的量随时间变化如图中实线所示(图中字母后的数字表示对应的坐标):
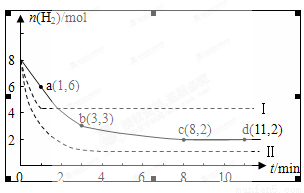
回答下列问题:
(1)由图分析,在下列时间段内反应速率最快的时间段是 (填答案编号)
a.0~1min b.1~3min c.3~8min d.8~11min
(2)该反应在0~8min内CO2的平均反应速率是 mol/(L•min).
(3)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示.与实线相比,曲线Ⅰ改变的条件可能是 ,曲线Ⅱ改变的条件可能是
若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条件下平衡常数为K2,则K、K1和K2的大小关系是
(4)下列表述能表示该反应已达平衡的是 (填答案编号)
a.容器内压强不再改变 b.容器内气体的密度不再改变
c.容器内气体平均摩尔质量不再改变 d.容器内各物质的物质的量相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com