
对于已浸入盐酸的![]() ,发生如下反应:
,发生如下反应:![]() (固)+2HCl=
(固)+2HCl=![]() +
+![]() +
+![]() ↑下列措施能使反应速率改变的是
↑下列措施能使反应速率改变的是
[ ]
科目:高中化学 来源: 题型:
| 次数 | 滴定前(mL) | 滴定后(mL) |
| 1 | 0.40 | 21.10 |
| 2 | 0.10 |
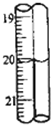 第2次滴定后滴定管的读数如图所示,将这一读数填入上表中.根据表中的数据计算出盐酸的浓度为
第2次滴定后滴定管的读数如图所示,将这一读数填入上表中.根据表中的数据计算出盐酸的浓度为查看答案和解析>>
科目:高中化学 来源: 题型:
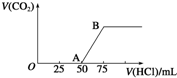 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )A、OA段所发生反应的离子方程式:H++OH-═H2O;CO32-+H+═HCO
| ||
| B、NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1 | ||
| C、产生的CO2体积(标准状况下)为0.056 L | ||
| D、原NaOH溶液的物质的量浓度为0.5 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源:高二化学(中学生学科素质训练与检测丛书) 题型:013
对于已浸入盐酸的![]() ,发生如下反应:
,发生如下反应:![]() (固)+2HCl=
(固)+2HCl=![]() +
+![]() +
+![]() ↑下列措施能使反应速率改变的是
↑下列措施能使反应速率改变的是
[ ]
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省临沂市高三上学期期中考试化学试卷(解析版) 题型:填空题
甲、乙、丙、丁四种物质中,甲、乙、丙均含有某种相同的元素,它们之间具有如下转化关系(反应条件和部分产物已略去):
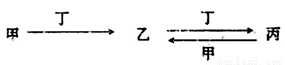
(1)若甲为常见金属单质,甲和丁的稀溶液反应生成无色气体,该气体遇空气变为红棕色。
①检验丙溶液中金属阳离子的试剂为________(填试剂名称)。
②向含n mol丁的稀溶液中加入m mol单质甲,二者恰好完全反应(假设还原产物只有上述无色气体),则n:m可能为__________(填代号)。
a.3:2 b.4:1 c.5:1 d.3:1
③常温下,丁的浓溶液可存放于甲制作的容器中,其原因是________________。
(2)若甲为氯碱工业的产品,含丙的某种药品可用于治疗胃酸过多。
①鉴别等浓度的乙溶液和丙溶液,可选用的试剂为________(填代号)
a.NaOH溶液 b.CaC12溶液 c.稀硫酸 d.澄清石灰水
②将甲、乙、丙三种溶液混合,向混合液中逐滴加入一定浓度的盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如下图所示:
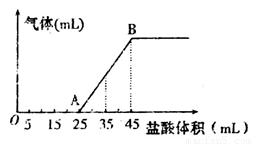
写出OA段所发生反应的离子方程式__________________________,当加入35mL盐酸时,产生气体的体积为22.4mL(标准状况),则盐酸的物质的量浓度为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com