
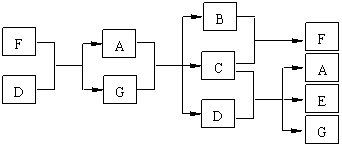
 ��ͼ��ʾ,��֪G ��A�ֱ��Ǻ�ˮ�к����������ֻ����E�ǡ�84������Һ����Ҫ�ɷ֣���ش���������
��ͼ��ʾ,��֪G ��A�ֱ��Ǻ�ˮ�к����������ֻ����E�ǡ�84������Һ����Ҫ�ɷ֣���ش���������
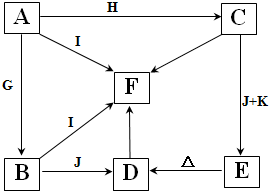
��1��д��C��E�ĵ���ʽC ��E
��2����ҵ��ͨ�����õ������״̬��A���Ʊ�ʱij�ֵ��ʣ�д�����Ļ�ѧ����ʽ
��
��3����ҵ���ڵ��A ��G �Ļ����ʱ������ ���缫���ϣ������豸���������ӽ���Ĥ���ۣ������ӽ���Ĥ��������
��
��4�������ϵĵ缫��ӦʽΪ ����ͬʱ�����缫���������뼸�η�̪��Һ�����������۲쵽��������_______________________________��
�����ϵĵ缫��ӦʽΪ ������õ缫��Ӧ����ķ�����__________________________________________________________��
��5��C��G��Ӧ��������һ��ǿ���һ�����ᣬд����ѧ��Ӧ����ʽ ��
��������� �ԣ�������ɱ��������

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
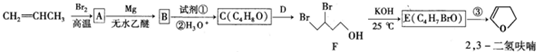
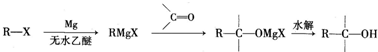


 �������û�ѧ����ʽ��ʾ��
�������û�ѧ����ʽ��ʾ�� +H2
+H2| ���� |

 +H2
+H2| ���� |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
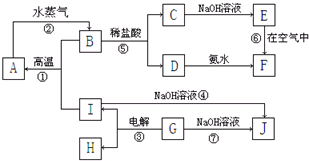
 A-K����ѧ��ѧ�г����ļ������ʣ�����֮���ת����ϵ��ͼ��ʾ����֪������AΪ���嵥�ʣ�BΪ����ɫ��ĩ��G��HΪ��̬���ʣ�I�ڳ�����ΪҺ�壬D��E��F��ˮ��Һ���ʼ��ԣ���C�ı�����Һ��ȡF��E����Ҫ�Ļ����������ش��������⣺
A-K����ѧ��ѧ�г����ļ������ʣ�����֮���ת����ϵ��ͼ��ʾ����֪������AΪ���嵥�ʣ�BΪ����ɫ��ĩ��G��HΪ��̬���ʣ�I�ڳ�����ΪҺ�壬D��E��F��ˮ��Һ���ʼ��ԣ���C�ı�����Һ��ȡF��E����Ҫ�Ļ����������ش��������⣺
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
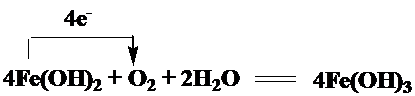
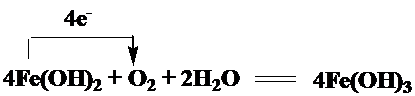
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
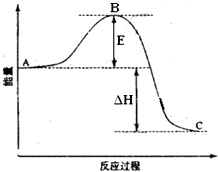 ��ͬ���������ת���ķ�Ӧ���൱�ٶ���ת�����ʽ�������ʱ���ܲ���ȫ���ⶨ��Ӧ�Ⱥ����ѣ����ڿɸ��ݸ�˹���ɽ��м��㣮
��ͬ���������ת���ķ�Ӧ���൱�ٶ���ת�����ʽ�������ʱ���ܲ���ȫ���ⶨ��Ӧ�Ⱥ����ѣ����ڿɸ��ݸ�˹���ɽ��м��㣮| 5 |
| 4 |
| 1 |
| 4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
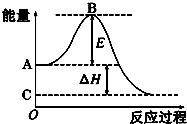 2CO��g��+O2��g��?2CO2��g����Ӧ���̵������仯��ͼ��ʾ����֪1mol CO ��g������Ϊ1mol CO2 ��g���ġ�H=-283kJ/mol����ش��������⣺
2CO��g��+O2��g��?2CO2��g����Ӧ���̵������仯��ͼ��ʾ����֪1mol CO ��g������Ϊ1mol CO2 ��g���ġ�H=-283kJ/mol����ش��������⣺�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com