
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率减少了 | ||
| C. | 物质B的质量增重了 | D. | a>b |
分析 采用假设法分析,保持温度不变,将容器体积缩小一半,假设平衡不移动,A和B的浓度应均是原来的2倍,但当达到新的平衡时,B的浓度均是原来的1.6倍,说明增大压强平衡逆反应方向移动,则说明a<b,据此判断.
解答 解:保持温度不变,将容器体积缩小一半,假设平衡不移动,A和B的浓度应均是原来的2倍,但当达到新的平衡时,B的浓度均是原来的1.6倍,说明增大压强平衡逆反应方向移动,则说明a<b,则
A、由上述分析可知,平衡逆反应方向移动,故A错误;
B、平衡逆反应方向移动,故A的转化率降低,故B正确;
C、平衡逆反应方向移动,B的质量减小,混合气体的总质量不变,故B的质量分数减小,质量减小,故C错误;
D、增大压强平衡逆反应方向移动,则说明a<b,故D错误;
故选B.
点评 本题考查化学平衡移动问题,题目难度不大,注意通过改变体积浓度的变化判断平衡移动的方向,此为解答该题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是
A.υ(W)=3υ(Z) B.2υ(X)=3υ(Z) C.2υ(X)=υ(Y) D.3υ(W)=2υ(X)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
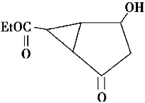 及其核磁共振氢谱图如下:下列关于该有机物的叙述正确的是( )
及其核磁共振氢谱图如下:下列关于该有机物的叙述正确的是( )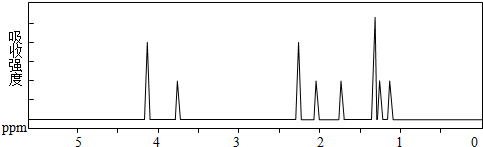
| A. | 该有机物不同化学环境的氢原子有6种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物的分子式为C9H12O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCl2完全反应转移电子数一定为2×6.02×1023 | |
| B. | 因SO2具有漂白性,故可使品红溶液、酸性KMnO4溶液褪色 | |
| C. | 常温下,$\frac{c(OH-)}{c(H+)}$=10-10的溶液中:Na+、Al3+、SO42-、NO3-可大量共存 | |
| D. | 将20.0gNaOH固体置入500mL容量瓶,然后加水至刻度线即得1.00mol/L的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
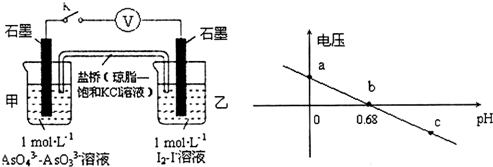
| A. | a点时,盐桥中K+向左移动 | |
| B. | b点时,反应处于化学平衡状态 | |
| C. | c点时,正极的电极反应为AsO43-+2H++2e-=AsO33-+H2O | |
| D. | pH>0.68时,氧化性I2>AsO43- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中NO与O2的体积之比为4:1 | |
| B. | 水吸收后的剩余气体是O2,且c=$\frac{a}{6}$ | |
| C. | 取m g AgNO3溶于水再加足量盐酸可生成沉淀$\frac{2a}{3×22.4}$×143.5g | |
| D. | 水吸收后所得溶液中HNO3的物质的量浓度为$\frac{b}{108}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ⅠFe(s)+CO2(g)=FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ⅡFe(s)+H2O(g)=FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ⅢCO(g)+H2O(g)=CO2(g)+H2(g) | K3 | ? | ? |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com