
【题目】下列关于反应Cu+2H2SO4![]() CuSO4+SO2↑+2H2O说法正确的是( )
CuSO4+SO2↑+2H2O说法正确的是( )
A.H2SO4是还原剂B.Cu在反应中被氧化
C.H2SO4在反应中只表现氧化性D.1mol氧化剂在反应中得到1mol电子
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性能,被广泛应用于电子工业、陶瓷工业 等领域,其结构类似于金刚石。一定条件下,氮化铝可通过反应 Al2O3+N2+3C=2AlN+3CO 合成, 下述正确的是
A.氮化铝晶体属于分子晶体
B.由于 AlN 相对分子质量比立方 BN 大,所以熔沸点 AlN 比 BN 高
C.AlN 中原子 Al 杂化方式为 sp2,N 杂化方式为 sp3
D.氮化铝晶体中含有配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2制备金属钛。下列说法正确的是

A. 电解过程中,Ca2+向阳极移动
B. 阳极的电极反应式为: C+2O2--4e-=CO2↑
C. 在制备金属钛前后,整套装置中CaO的总量减少
D. 若用铅蓄电池作该装置的供电电源,“+”接线柱连接的是Pb电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图为实验室某浓盐酸试剂瓶标签上的有关数据,根据数据计算该浓盐酸中HCl的物质的量浓度为____________。

(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是______.
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.400mol/L的稀盐酸。
①该学生需要量取______mL上述浓盐酸进行配制,确定溶液体积的容器是________(填名称)。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填“偏大”、“偏小”或“无影响”)。
a.实验前,容量瓶中有少量蒸馏水.___________。
b.用量筒量取浓盐酸时俯视观察凹液面.__________。
c.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水.__________。
(4)①假设该同学成功配制了0.400mol/L的盐酸,他又用该盐酸中和含0.4gNaOH的NaOH溶液,则该同学需取______mL盐酸.
②假设该同学用新配制的盐酸中和含0.4gNaOH的溶液,发现比①中所求体积偏小,则可能的原因是________________。
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.FeCl3溶液腐蚀铜线路板:Fe3++Cu=Fe2++Cu2+
B.氯气通入水中:Cl2+H2O=2H++ClO-+Cl-
C.金属铝加入到NaOH溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑
D.Na2O加入稀硫酸中:O2-+2H+=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,它们原子的核电荷数均小于18,且依次递增。A原子核内仅有1个质子,B原子的电子总数与D原子的最外层电子数相等,A原子与B原子的最外层电子数之和与C原子的最外层电子数相等,D原子的最外层电子数是次外层电子数的3倍。
(1)请写出这四种元素元素名称:A_____;B_____;C_____;D_____。
(2)A与C形成常见化合物的化学式是_____,该化合物的水溶液呈_____性。
(3)B与D形成的化合物能溶于水,且与水反应的化学方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D是四种短周期元素,E是过渡元素。A,B,C同周期,C,D同主族,A的原子结构示意图为![]() ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A______,B____,C_____,D_____。
(2)用化学式表示上述五种元素中最高价氧化物对应水化物碱性最强的是____。
(3)E元素原子的核电荷数是_________
(4)写出D元素原子构成单质的电子式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)I的最高化合价为___,I的元素名称为___。
(2)写出基态时K元素原子的电子排布式___,J元素原子的外围电子排布式___。
(3)下列对比正确的是___。
a.原子半径H>G>B>A
b.第一电离能E>D>C>B
c.电负性A>H>G>Q
d.最高价氧化物的水化物酸性B>A>H>G
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是___。
a.L位于元素周期表第五周期ⅠA族,属于s区元素
b.O位于元素周期表第七周期Ⅷ族,属于ds区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是几种晶体的结构示意图,它们是NaCl、干冰、金刚石、石墨结构中的一部分。
A.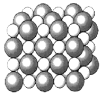 B.
B. C.
C.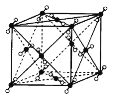 D.
D.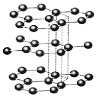
(1)其中代表金刚石的是______(填序号),金刚石属于______晶体。
(2)其中代表石墨的是______(填序号),其晶体中碳原子呈平面层状结构排列。
(3)其中代表NaCl的是______(填序号),晶体中Na+与Cl-之间通过______结合。
(4)其中代表干冰的是______(填序号),它属于晶体______,CO2分子间通过______结合。
(5)A、B、C所代表物质的熔点由高到低的排列顺序为______(填序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com