
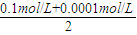 =1.005×10-2mol/L,则氢离子浓度=
=1.005×10-2mol/L,则氢离子浓度=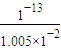 mol/L=2×10-12mol/L,
mol/L=2×10-12mol/L,

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2015届甘肃省高二上学期期末考试化学试卷(解析版) 题型:计算题
列式并计算下列各小题:
(1)某温度时,测得0.01 mol/L的NaOH溶液pH为11,求该温度下水的离子积常数Kw
(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。
①若所得混合溶液为中性,且a=12,b=2,求Va ∶Vb 。
②若所得混合溶液的pH=10,且a=12,b=2,求Va∶Vb 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com