
用如图所示装置进行下列实验,能达到实验目的是( )
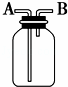
A. 瓶中盛有适量浓H2SO4,从A口进气来干燥NH3
B. 从B口进气,用排空气法收集CO2
C. 瓶中盛满水,从B口进气,用排水法收集NO2
D. 瓶中装满水,A口连接导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积
考点: 实验装置综合.
专题: 实验设计题.
分析: A.浓硫酸与氨气能反应;
B.二氧化碳的密度比空气大;
C.NO2能与水反应;
D.排水法收集气体时,短管进气,长管出水.
解答: 解:A.浓硫酸与氨气能反应,所以不能用浓硫酸干燥氨气,故A错误;
B.二氧化碳的密度比空气大,应该用向上排空气法收集,则A管进二氧化碳,B管出空气,故B错误;
C.NO2能溶于水而且与水反应生成硝酸和NO,所以不能用排水法收集,故C错误;
D.氢气难溶于水,排水法收集气体时,短管进气,长管出水,则瓶中装满水,A口连接导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积,故D正确.
故选D.
点评: 本题考查了基本实验操作,侧重于考查气体的干燥、收集以及排水法收集气体,题目难度不大.


科目:高中化学 来源: 题型:
碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,分子中氢原子个数为氧的5倍.一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团.且B的核磁共振氢谱显示有3组不同的峰.
(1)A的分子式是 .
(2)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量相等且生成水的量也相等的是 (填序号).
A.C5H12O3 B.C4H10 C.C6H10O4 D.C5H10O
(3)①B的结构简式是 .
②A不能发生的反应是 (填序号).
A.取代反应 B.消去反应 C.酯化反应 D.还原反应
(4)A还有另一类酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,该异构体的结构简式是: .
(5)写出B与乙二酸发生缩聚反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学与生产、生活的认识不正确的是( )
|
| A. | CO2、CH4、N2等均是造成温室效应的气体 |
|
| B. | 使用清洁能源是防止酸雨发生的重要措施之一 |
|
| C. | 节能减排符合低碳经济的要求 |
|
| D. | 合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如图.关于A的下列说法中,正确的是( )
|
| A. | 1molA在碱性条件下水解消耗2molNaOH |
|
| B. | A在一定条件下可与4 mol H2发生加成反应 |
|
| C. | 符合题中A分子结构特征的有机物只有1种 |
|
| D. | 与A属于同类化合物的同分异构体只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体.
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为 ;为了吸收该反应中产生的尾气,请选择下列中合适的装置 .
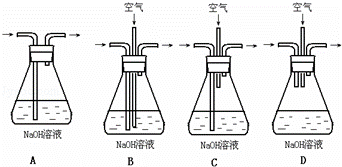
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂.将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加少量FeSO4,即发生反应,生成硫酸铜.反应完全后,加物质甲调节pH,铁元素全部沉淀(一般认为铁离子的浓度下降到10﹣5mol•L﹣1,就认为沉淀完全),然后过滤、浓缩、结晶.
已知:Ksp≈10﹣22,Ksp≈10﹣16,Ksp≈10﹣38
请回答下列问题:
如开始加入的铜粉为3.2g,最后所得溶液为500mL,溶液中含有铁元素0.005mol.
①方案1中的B仪器名称是 .
②为了使铁元素全部沉淀,应调节pH至少为 .
③方案2中甲物质可选用的是 .
A、CaO B、NaOH C、CuCO3 D、Cu2(OH)2CO3 E、Fe2(SO4)3
④反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因 .
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45mL 1.5mol•L﹣1的稀硫酸中,控温在50℃.加入18mL 10%的H2O2,反应0.5h,升温到60℃,持续反应1h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4•5H2O 10.5g.
请回答下列问题:
⑤反应时温度控制在50℃~60℃不宜过高的原因是 ,
⑥本实验CuSO4•5H2O的产率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式正确的是( )
A. NaAlO2溶液中通入过量的CO2:2AlO2﹣+3H2O+CO2═2Al(OH)3↓+CO32﹣
B. 明矾溶液中滴加Ba(OH)2溶液至SO42﹣完全沉淀:Al3++Ba2++SO42﹣+3OH﹣═BaSO4↓+Al(OH)3↓
C. 200 mL 2 mol/L的FeBr2溶液中通入11.2 L标准状况下的氯气:4Fe2++6Br﹣+5Cl2═4Fe3++3Br2+10Cl﹣
D. 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO﹣+2Fe(OH)3═2FeO42﹣+3Cl﹣+H2O+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应可能会生成Na2O2的是( )
A. 金属钠高温还原CO2,制人工金刚石膜或粉
B. 汽车气囊中用氧化铁除去NaN3受撞击时分解生成的钠
C. 隔绝空气条件下加热金属钠与NaNO2反应制取Na2O
D. 将4.6 g钠与1.6g硫粉迅速混合起来,并放在石棉网上加热
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A. 1molH2O的质量为18g/mol
B. CH4的摩尔质量是16g
C. 6.02×1023个O2分子的质量为32g
D. 标准状况下,1mol任何物质的体积均为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)BCl3和NCl3中心原子的杂化方式分别为 和 .第一电离能介于B、N之间的第二周期元素有 种.
(2)若BCl3与XYm通过B原子与X原子间的配位健结合形成配合物,则该配合物中提供孤对电子的原子是 .
(3)BF3与一定量水形成(H2O)2•BF3晶体Q,Q在一定条件下可转化为R:
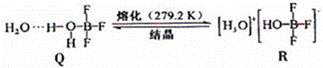
①晶体Q中各种微粒间的作用力不涉及 (填序号).
a.离子键 b.共价键 c.配位键 d.氢键e.范德华力
②R中阳离子的空间构型为 ,阴离子的中心原子轨道采用 杂化.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com