
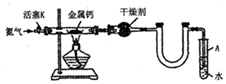
 利用如图装置,可以在室温和一个标准大气压条件下测定镁的相对原子质量.
利用如图装置,可以在室温和一个标准大气压条件下测定镁的相对原子质量.分析 根据实验原理即测定一定质量的镁与足量的稀硫酸反应生成的氢气体积,根据氢气的量计算镁的物质的量,最后再根据M=$\frac{m}{n}$计算镁的相对原子质量,测量氢气体积时注意量气管的使用方法,据此分析解答.
解答 解:(1)根据实验原理镁与足量的稀硫酸反应,所以在Y型管中添加试剂时,要确保稀硫酸过量,故答案为:稀硫酸;
(2)反应前后应调整量气管和水准管液面相平,保持装置内外压强;若读数时,量气管中的液面低于水准管的液面,说明内部气压大于大气压,则量气管中气体的体积将偏小,故答案为:装置内外压强;偏小;
(3)根据镁与硫酸反应的方程式Mg+H2SO4=MgSO4+H2↑,则镁的物质的量为$\frac{a×10{\;}^{-3}L}{22.4L/mol}$,所以镁的相对原子质量M=$\frac{m}{n}$=$\frac{m}{\frac{a×10{\;}^{-3}}{22.4}}$=$\frac{22400m}{a}$,故答案为:$\frac{22400m}{a}$.
点评 本题考查了测定镁的相对原子质量的分析判断,量气管的使用方法是难点,题目难度中等.


科目:高中化学 来源: 题型:实验题
| 空瓷舟质量m0/g | 瓷舟与钙的质量m1/g | 瓷舟与产物的质量m2/g |
| 14.80 | 15.08 | 15.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应条件下,初始时向容器中充入2molSO2和1molO2,反应平衡时,可以释放198.0 kJ的热量 | |
| B. | 达到平衡时,SO2和SO3的浓度一定相等 | |
| C. | 反应体系中,当混合物的密度保持不变,反应达到平衡 | |
| D. | 增大压强和升高温度有利于加快反应速率,但升高温度对平衡转化率不利 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加催化剂 | B. | 升高温度 | C. | 减小压强 | D. | 加入O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
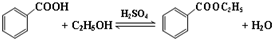
| 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 环己烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 环己烷、乙醇和水共沸物 | 62.1 |

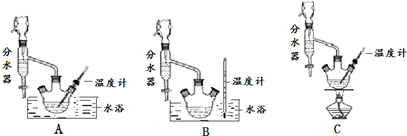
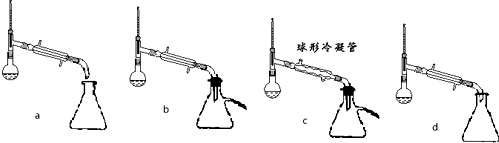
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持体积不变加入H2 | B. | 压缩体积至原来的一半 | ||
| C. | 降低温度 | D. | 加入催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com